Labfremstillede proteinkugle co-faktor som en stor ol gator
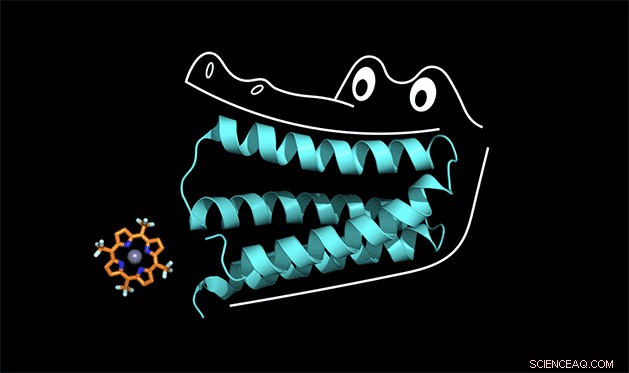
Det syntetiske protein klemmer sig fast på porphyrinen som en alligators kæber. Kredit:Nicholas Polizzi
Proteiner har magt til at turbolade biokemiske reaktioner inde i kroppen.
Uden hjælp af proteintyper kaldet enzymer, reaktionen, der bygger DNA, kan tage over 130, 000 år at gennemføre. Enzymer reducerede den tid til kun et par millisekunder.
For at øge kemiske reaktioner, mange proteiner går sammen med mindre molekyler eller metaller kaldet kofaktorer. Kemikere vil gerne designe proteiner, der binder til ikke-biologiske kofaktorer for at fremskynde kemiske reaktioner, der ikke findes i naturen. Men først, de skal finde ud af, hvordan man skaber menneskeskabte proteiner, der fastgøres til nye kofaktorer på den helt rigtige måde, og det er ikke let.
Et team af kemikere ved Duke og UC San Francisco er de første til at løse dette puslespil med proteindesign. Teamet skabte et syntetisk protein, der tæt binder en ikke-biologisk katalysator, en type molekyle kaldet porphyrin, der er i stand til at stjæle elektroner fra andre molekyler, når det absorberer lys.
"At være i stand til at kombinere menneskeskabte katalysatorer med proteiner ville være rigtig stort inden for kemi, for så kunne du kombinere et enzyms kraft med reaktionen, der ikke findes i naturen, "sagde den tidligere hertugstuderende Nicholas Polizzi, som nu er postdoktor i William DeGrado's laboratorium ved UCSF.
"Vi var i stand til at finde ud af de designkriterier, der var nødvendige for at placere dette porphyrin i et protein inden for en meget høj nøjagtighed, "Polizzi sagde." Det var en virkelig stor springbræt for at kunne designe nye kombinationer af proteinkofaktorer, der ikke ses i naturen. "
Proteiner er fremstillet af kæder af hundredvis eller tusinder af mindre aminosyrer, der snor sig og går i komplekse 3D-former, der kan sammenlænge med andre molekyler som stykker af et puslespil. For at katalysere kemiske reaktioner, proteinkofaktor-kombinationer rummer to eller flere molekyler i præcist formede lommer, der holder molekylerne i de helt rigtige positioner, og give det rigtige miljø, for at der kan opstå en kemisk reaktion.
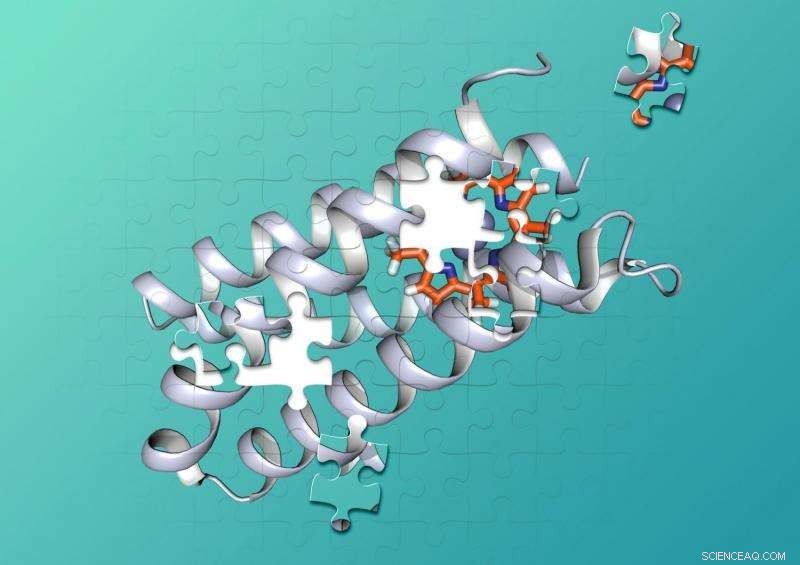
Kemikere ved Duke og UCSF designede et syntetisk protein, der tæt binder et ikke-biologisk molekyle. Kredit:Nicholas Polizzi
Millioner af år med evolution har skabt proteiner, der foldes ind i de former, der strammer fat i specifikke kofaktorer og giver de perfekte miljøer til at katalysere kemiske reaktioner.
I over 25 år har kemikere har brugt det, de ved om proteinfoldning, til at designe syntetiske aminosyresekvenser, der snor sig til nyttige former. Men indtil videre, de har ikke været i stand til at designe et protein, der binder en ikke-biologisk kofaktor med den præcision, der er nødvendig for at drive komplekse nye kemiske reaktioner.
Polizzi sagde, at dette kan skyldes, at disse designs primært fokuserede på "bindingsstedet", hvor kofaktorer og reagerende molekyler passer ind i proteinet, mens man ignorerer resten af strukturen. "Hvad jeg gjorde anderledes er, at jeg i det væsentlige betragtede hele proteinets indre som bindingsstedet for porphyrinet, i modsætning til blot et par aminosyrer, der berører porphyrin, "Sagde Polizzi.
For at forstå, hvordan dette fungerer, du kan tænke på proteinet som en alligators mund sagde Michael Therien, William R. Kenan Jr. Professor i kemi ved Duke. Proteinet låser sig fast på en kofaktor på samme måde, som en alligator bruger sine fortænder til at chomp ned på middagen. Men for at fortænderne får et stærkt greb, kæben og bagtænderne skal også designes korrekt.
"Det nye koncept her er, at proteinets ikke-bindende region holdes i en form, der gør det muligt for bindingsområdet at arbejde, "Sagde Therien.
"Vi kaldte proteinet 'gator' i laboratoriet, "Sagde Polizzi.
Gatorproteinets kæber klemmer faktisk så hårdt på porphyrinkofaktoren, at hele strukturen er for stiv til at katalysere en reaktion, Sagde Polizzi. Men med et par justeringer til at løsne strukturen, han tror, han kan få det til at fungere.
"I denne reaktion, ofte har du brug for en lille smule vrikkerum i proteinet for at det kan bevæge sig. Og der var ikke noget vrimlerum i vores protein, alt passer for perfekt, "Sagde Polizzi.
Sidste artikelNye farvestoffer registrerer sygdom gennem hjerteslagssignaler
Næste artikelHærforskere opdager magt i urinen
 Varme artikler
Varme artikler
-
 Argon er ikke stoffet til metallisk brintEn illustration af Ar(H2)2 i diamantamboltcellen. Pilene repræsenterer forskellige måder, hvorpå spektroskopiske værktøjer studerer effekten af ekstreme tryk på stoffets krystalstruktur og molekylær
Argon er ikke stoffet til metallisk brintEn illustration af Ar(H2)2 i diamantamboltcellen. Pilene repræsenterer forskellige måder, hvorpå spektroskopiske værktøjer studerer effekten af ekstreme tryk på stoffets krystalstruktur og molekylær -
 Discovery lyser vej til Alzheimers -forskningEt rheniumbaseret kompleks udviklet ved Rice University binder sig til fibriller af forkert foldet amyloid beta-peptid, som markerer placeringen af en hydrofob spalte, der kan tjene som et lægemidde
Discovery lyser vej til Alzheimers -forskningEt rheniumbaseret kompleks udviklet ved Rice University binder sig til fibriller af forkert foldet amyloid beta-peptid, som markerer placeringen af en hydrofob spalte, der kan tjene som et lægemidde -
 En ny sensor til lys, varme og berøringSensoren, der kan måle ændringer i kropstemperatur, og reagerer på både sollys og varm berøring. Kredit:Thor Balkhed Inspireret af opførsel af naturlig hud, forskere ved Laboratory of Organic Elec
En ny sensor til lys, varme og berøringSensoren, der kan måle ændringer i kropstemperatur, og reagerer på både sollys og varm berøring. Kredit:Thor Balkhed Inspireret af opførsel af naturlig hud, forskere ved Laboratory of Organic Elec -
 Biomimetisk kemi - DNA-mimiker overliste viralt enzymRepræsentationer af en B-DNA dobbelt helix og en enkelt spiralformet foldamer efterligner. Kredit:Ivan Huc, LMU Ikke alene kan syntetiske molekyler efterligne strukturerne i deres biologiske model
Biomimetisk kemi - DNA-mimiker overliste viralt enzymRepræsentationer af en B-DNA dobbelt helix og en enkelt spiralformet foldamer efterligner. Kredit:Ivan Huc, LMU Ikke alene kan syntetiske molekyler efterligne strukturerne i deres biologiske model
- Olympiske matematikaktiviteter til grundlæggende
- Videnskabelig formel beregner, hvordan man skaber mere plads til fodgængere i post-pandemiske byer
- Viser forureningsvejen mellem stratosfæren og troposfæren
- Ved hjælp af innovativ 3-D printmetode, forskere gengiver den millimeter høje Michelangelos David
- Huledykkere søger i dybder efter istidens knogler
- Du er produktet:Facebooks forretningsmodel forklaret


