Discovery lyser vej til Alzheimers -forskning
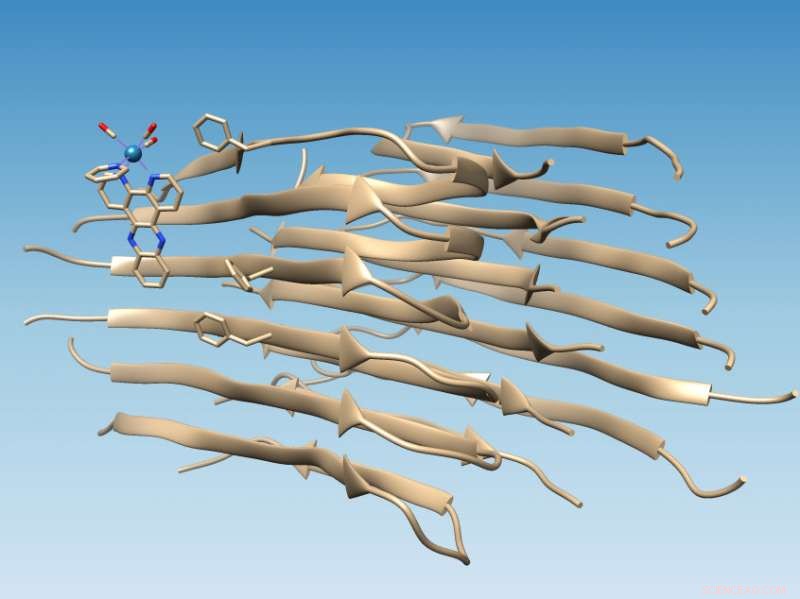
Et rheniumbaseret kompleks udviklet ved Rice University binder sig til fibriller af forkert foldet amyloid beta-peptid, som markerer placeringen af en hydrofob spalte, der kan tjene som et lægemiddelmål, og oxiderer fibrillen, som ændrer sin kemi på en måde, der kunne forhindre yderligere aggregering. Kredit:Martí Group/Rice University
En probe opfundet på Rice University, der lyser, når den binder sig til et forkert foldet amyloid beta -peptid - den formodede form for at forårsage Alzheimers sygdom - har identificeret et specifikt bindingssted på proteinet, der kunne lette bedre lægemidler til behandling af sygdommen.
Endnu bedre, laboratoriet har opdaget, at når den metalsonde er oplyst, det katalyserer oxidation af proteinet på en måde, de tror, kan forhindre det i at aggregeres i hjernen hos patienter.
Undersøgelsen udført på lange amyloidfibriller bakker op om computersimuleringer af kolleger ved University of Miami, der forudsagde, at det fotoluminescerende metalkompleks ville binde sig til amyloidpeptidet nær en hydrofob (vandundgående) kløft, der vises på overfladen af fibrilaggregatet. Denne spalte præsenterer et nyt mål for medicin.
At finde stedet var relativt enkelt, når laboratoriet hos riskemikeren Angel Martí brugte sine rheniumbaserede komplekser til at målrette fibriller. Det lysskiftende kompleks lyser, når det rammes af ultraviolet lys, men når det binder sig til fibrillen, bliver det mere end 100 gange lysere og forårsager oxidation af amyloidpeptidet.
"Det er som at gå på stranden, "Sagde Marti." Du kan se, at der var nogen før dig ved at se på fodspor i sandet. Selvom vi ikke kan se rheniumkomplekset, vi kan finde den oxidation (fodaftryk), den producerer på amyloidpeptidet.
"Den oxidation sker kun lige ved siden af det sted, hvor den binder sig, "sagde han." Den egentlige betydning af denne forskning er, at vi med høj grad af sikkerhed kan se, hvor molekyler kan interagere med amyloide betafibriller. "
Undersøgelsen fremgår af tidsskriftet Chem .
"Vi mener, at denne hydrofobe kløft er et generelt bindingssted (på amyloid beta) for molekyler, "Martí sagde." Dette er vigtigt, fordi amyloid beta -aggregering har været forbundet med starten af Alzheimers sygdom. Vi ved, at fibrillær uopløselig amyloid beta er giftig for cellekulturer. Opløselige amyloidoligomerer, der er lavet af flere fejlfoldede enheder af amyloid beta, er også giftige for celler, sandsynligvis endnu mere end fibrillar.
"Der er en interesse i at finde medicin, der vil slukke de skadelige virkninger af amyloid beta -aggregater, "sagde han." Men for at skabe medicin til disse, vi skal først vide, hvordan lægemidler eller molekyler generelt kan binde og interagere med disse fibriller, og dette var ikke kendt. Nu har vi en bedre idé om, hvad molekylet har brug for for at interagere med disse fibriller. "

En metallisk sonde lyser op, når den binder sig til et forkert foldet amyloid beta -peptid i et forsøg på Rice University. Sonden identificerede et bindingssted, der kunne lette bedre lægemidler til behandling af Alzheimers sygdom. Kredit:Brandon Martin/Rice University
Når amyloide peptider foldes ordentligt, de skjuler deres hydrofobe rester, mens de udsætter deres hydrofile (vandtrækkende) rester for vand. Det gør proteinerne opløselige, Sagde Martí. Men når amyloid beta misfoldes, det efterlader to hydrofobe rester, kendt som Valine 18 og Phenylalanine 20, udsat for at skabe den hydrofobe kløft.
"Det er perfekt, fordi så molekyler med hydrofobe domæner drives til at binde der, "Sagde Martí." De er kompatible med denne hydrofobe kløft og forbinder med fibrillen, danner en stærk interaktion. "
Hvis den resulterende oxidation forhindrer fibrillerne i at aggregere længere ind i det klæbrige stof, der findes i hjernen hos Alzheimers patienter, det kan være starten på en nyttig strategi til at stoppe aggregering, før symptomer på sygdommen viser sig.
"Det er et meget attraktivt system, fordi det bruger lys, som er en billig ressource, "Sagde Martí." Hvis vi kan ændre komplekser, så de absorberer rødt lys, som er gennemsigtig for væv, vi kan muligvis udføre disse fotokemiske ændringer i levende dyr, og måske en dag hos mennesker. "

Fra venstre, Rice University forsker Christopher Pennington, kandidatstuderende Bo Jiang og Angel Martí, lektor i kemi og bioingeniør, køre et amyloid beta -eksperiment i Martí -laboratoriet. Kredit:Brandon Martin/Rice University
Han sagde, at lysaktivering tillader forskerne at have "udsøgt kontrol" med oxidation.
"Vi forestiller os, at det en dag kan være muligt at forhindre symptomer på Alzheimers ved at målrette amyloid beta på samme måde, som vi behandler kolesterol hos mennesker nu for at forhindre hjerte -kar -sygdomme, "Sagde Martí." Det ville være vidunderligt. "
 Varme artikler
Varme artikler
-
 Jagter lithium-ioner på farten i et hurtigt opladet batteriEt skematisk billede af den elektrokemiske minicelle, som forskerne byggede for at jage lithiumioner (orange), der bevæger sig i gitteret af LTO (blå). Kredit:Brookhaven National Laboratory Et tea
Jagter lithium-ioner på farten i et hurtigt opladet batteriEt skematisk billede af den elektrokemiske minicelle, som forskerne byggede for at jage lithiumioner (orange), der bevæger sig i gitteret af LTO (blå). Kredit:Brookhaven National Laboratory Et tea -
 Ikke-giftig teknologi udvinder mere guld fra malmKredit:Aalto Universitet, Robert von Bonsdorff Undersøgelse viser, at en ny chloridbaseret proces genvinder 84 % af guldet sammenlignet med de 64 %, der genvindes med traditionelle metoder. Guld
Ikke-giftig teknologi udvinder mere guld fra malmKredit:Aalto Universitet, Robert von Bonsdorff Undersøgelse viser, at en ny chloridbaseret proces genvinder 84 % af guldet sammenlignet med de 64 %, der genvindes med traditionelle metoder. Guld -
 Bæredygtig, stærkt selektiv biokatalytisk omdannelse af aldehyder til carboxylsyrerForsidebillede af den aktuelle udgave af Green Chemistry med HIMS/Biocat -forskningen. Forskere fra University of Amsterdams Vant Hoff Institute for Molecular Sciences (HIMS) har udviklet den førs
Bæredygtig, stærkt selektiv biokatalytisk omdannelse af aldehyder til carboxylsyrerForsidebillede af den aktuelle udgave af Green Chemistry med HIMS/Biocat -forskningen. Forskere fra University of Amsterdams Vant Hoff Institute for Molecular Sciences (HIMS) har udviklet den førs -
 C. elegans rundorme høster et vigtigt coenzym fra de bakterier, de indtagerCaenorhabditis elegans. Kredit:Wikipedia En undersøgelse udført i C. elegans nematode rundorm kan føre til forbedret behandling af en sjælden menneskelig genetisk lidelse, der forårsager alvorli
C. elegans rundorme høster et vigtigt coenzym fra de bakterier, de indtagerCaenorhabditis elegans. Kredit:Wikipedia En undersøgelse udført i C. elegans nematode rundorm kan føre til forbedret behandling af en sjælden menneskelig genetisk lidelse, der forårsager alvorli
- Sådan beregnes procentvis tilbagegang
- Detailhandlere leder efter måder at slippe af med kassen
- Plast:Den nye energikilde
- Asteroide flyver sikkert forbi Jorden den 19. april
- Kemikere udvikler en ny måde at behandle antibiotika-resistente infektioner på
- National skraldespand:Reducering af affald produceret i amerikanske nationalparker


