Hvorfor er faste stoffer mere opløselige i varme væsker end kolde?
1. Øget kinetisk energi:
* varme væsker har molekyler, der bevæger sig hurtigere og med mere energi sammenlignet med kolde væsker. Denne øgede kinetiske energi forårsager flere kollisioner mellem flydende molekyler og det faste opløste stof.
* Disse kollisioner giver den energi, der er nødvendig for at bryde de intermolekylære kræfter Holder det faste stof sammen, så de opløste molekyler kan flygte fra det faste stof og opløses i væsken.
2. Svækkede intermolekylære kræfter:
* Når temperaturen stiger, svækkes de intermolekylære kræfter mellem flydende molekyler. Dette gør det lettere for de opløste molekyler at interagere med de flydende molekyler og opløses.
* for eksempel holdes vandmolekyler sammen af brintbindinger. Opvarmning af vandet svækker disse bindinger, hvilket gør det lettere for det faste stof at gå i stykker og opløses.
3. Øget entropi:
* Opløsning af en solid øger systemets lidelse (entropi). Varme væsker har mere entropi end kolde væsker. Denne øgede entropi gør opløsningsprocessen mere gunstig ved højere temperaturer.
Tænk på det sådan:
Forestil dig en mængde mennesker pakket tæt sammen (det solide). Hvis de alle står stille (kolde), er det svært at bevæge sig gennem dem. Men hvis de alle danser og bevæger sig rundt (varmt), er det meget lettere at glide mellem dem og komme til den anden side (opløses).
Vigtig note:
* Ikke alle faste stoffer følger denne regel. Nogle faste stoffer, som calciumsulfat, bliver * mindre * opløselig, når temperaturen øges. Dette skyldes komplekse kemiske reaktioner og ændringer i opløselighed, der er specifikke for stoffet.
Fortæl mig, hvis du gerne vil have flere detaljer om nogen af disse punkter!
Sidste artikelHvad er formelmassen på C3S2?
Næste artikelHvad er den bedste definition af entalpi -dannelse?
 Varme artikler
Varme artikler
-
 Skovforskere udvikler innovative træbaserede materialer til 3D-printBiopastaen, der bruges til at trykke denne cylinder, består af 50 procent lignin og 50 procent cellulose. Kredit:Lisa Ebers En tyktflydende biopasta, der er nem at behandle, størkner hurtigt og er
Skovforskere udvikler innovative træbaserede materialer til 3D-printBiopastaen, der bruges til at trykke denne cylinder, består af 50 procent lignin og 50 procent cellulose. Kredit:Lisa Ebers En tyktflydende biopasta, der er nem at behandle, størkner hurtigt og er -
 Beregningsanalyse afslører den komplekse adfærd af en polymerFigur 1:Konventionelle plastmaterialer som f.eks. Disse plasticchips fra genanvendte vandflasker er vanskelige at nedbryde i deres monomer byggesten. Nu, RIKEN -forskere har afsløret den komplekse dep
Beregningsanalyse afslører den komplekse adfærd af en polymerFigur 1:Konventionelle plastmaterialer som f.eks. Disse plasticchips fra genanvendte vandflasker er vanskelige at nedbryde i deres monomer byggesten. Nu, RIKEN -forskere har afsløret den komplekse dep -
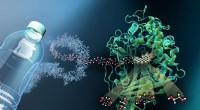 Forskere karakteriserer molekylær sakse til plastaffaldBilledet viser strukturen af MHETase bundet til en ikke-hydrolyserbar PET-afledt ligand (MHETA). Symbolske polymerfibre forbinder MHETA med en typisk PET-flaske, hvilket indikerer det store potentia
Forskere karakteriserer molekylær sakse til plastaffaldBilledet viser strukturen af MHETase bundet til en ikke-hydrolyserbar PET-afledt ligand (MHETA). Symbolske polymerfibre forbinder MHETA med en typisk PET-flaske, hvilket indikerer det store potentia -
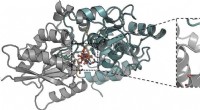 Sultende tuberkulose af sukkerarter kan være en ny måde at bekæmpe det påDetaljer på molekylært niveau af interaktionen af trehalose bundet til den mykobakterielle LpqY-transporter. Kredit:University of Warwick Tuberkulose er en ødelæggende sygdom, der kræver over 1,
Sultende tuberkulose af sukkerarter kan være en ny måde at bekæmpe det påDetaljer på molekylært niveau af interaktionen af trehalose bundet til den mykobakterielle LpqY-transporter. Kredit:University of Warwick Tuberkulose er en ødelæggende sygdom, der kræver over 1,
- Hvad er elektronkonfigurationen?
- At stille spørgsmålstegn ved byer, der skaber uligheder i rigdommen fra de udstødtes perspektiv
- En ny løser til omtrentlig marginal kortslutning
- Sådan laver du flydende CO2
- Californien har sendt en sms om brandfare til 12 millioner mennesker
- Nyt geoelektrisk farekort viser potentiel sårbarhed over for højspændingsnettet for to tredjedele…


