Hvad er den bedste definition af entalpi -dannelse?
Her er en sammenbrud af nøgleelementerne:
* entalpi: En termodynamisk egenskab, der repræsenterer det samlede varmeindhold i et system.
* dannelse: Processen med at skabe en forbindelse fra dens elementer.
* Standardtilstand: Den mest stabile form af et element ved en specificeret temperatur og tryk (normalt 298 K og 1 atm).
* Standardbetingelser: Sættet af betingelser, under hvilke entalpien af dannelsen måles (normalt 298 K og 1 atm).
vigtige punkter at huske:
* Tegnskonvention: Entalpi af dannelse kan være positiv (endotermisk reaktion, optaget varme) eller negativ (eksoterm reaktion, frigivet varme).
* Referencepunkt: Entalpien af dannelse af et element i dets standardtilstand defineres som nul.
* applikationer: Entalpi af dannelse bruges til at beregne entalpi -ændringer for forskellige reaktioner og til at bestemme den relative stabilitet af forbindelser.
for eksempel:
Entalpien af dannelse af vand (H₂O) er -285,8 kJ/mol. Dette betyder, at 285,8 kJ varme frigøres, når en mol vand dannes fra dens elementer (brintgas og iltgas) under standardbetingelser.
 Varme artikler
Varme artikler
-
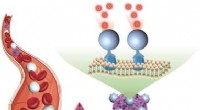 Direkte påvisning af cirkulerende tumorceller i blodprøverKredit:Wiley-VCH Tumorceller, der cirkulerer i blodet, er markører for tidlig opdagelse og prognose af kræft. Imidlertid, påvisning af disse celler er udfordrende på grund af deres knaphed. I jour
Direkte påvisning af cirkulerende tumorceller i blodprøverKredit:Wiley-VCH Tumorceller, der cirkulerer i blodet, er markører for tidlig opdagelse og prognose af kræft. Imidlertid, påvisning af disse celler er udfordrende på grund af deres knaphed. I jour -
 Stemplet, espresso, filter? Bare fordi din kaffe er bitter, betyder det ikke, at den er stærkereMoka-gryden, en anden ikonisk italiensk opfindelse, brygger kaffe ved høje temperaturer på en komfur. Kredit:Ccu.bat/Shutterstock Kaffe – en bønne med mange muligheder. Et stort valg er, hvordan ma
Stemplet, espresso, filter? Bare fordi din kaffe er bitter, betyder det ikke, at den er stærkereMoka-gryden, en anden ikonisk italiensk opfindelse, brygger kaffe ved høje temperaturer på en komfur. Kredit:Ccu.bat/Shutterstock Kaffe – en bønne med mange muligheder. Et stort valg er, hvordan ma -
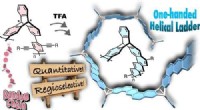 Syntese af spiralformede stigepolymererRapport:En effektiv syntese af optisk aktive stige-type molekyler og polymerer gennem intramolekylær ringslutning af chirale triptycener indeholdende bis[2-(4-alkoxyphenyl)ethynyl]phenylenenheder. De
Syntese af spiralformede stigepolymererRapport:En effektiv syntese af optisk aktive stige-type molekyler og polymerer gennem intramolekylær ringslutning af chirale triptycener indeholdende bis[2-(4-alkoxyphenyl)ethynyl]phenylenenheder. De -
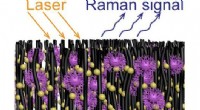 En hurtig og billig enhed til at fange og identificere viraArray af nanorør dekoreret med guld nanopartikler fanger virusmolekyler. Kredit:Terrones Lab/Penn State En enhed til hurtigt at fange og identificere forskellige virusstammer er blevet udviklet, i
En hurtig og billig enhed til at fange og identificere viraArray af nanorør dekoreret med guld nanopartikler fanger virusmolekyler. Kredit:Terrones Lab/Penn State En enhed til hurtigt at fange og identificere forskellige virusstammer er blevet udviklet, i
- Hvis et vakuum er blevet trukket på systemet, og der er lækage, vil måleren?
- At ramme bunden efter jobtab kan være gavnligt, viser undersøgelse
- Moiré-effekt:Sådan vrider du materialeegenskaber
- Hvad skal der til for at lukke kønsforskellen i fysik?
- Metamateriale forbedrer signifikant chirale nanopartikelsignaler
- Hvad er forskellen i fysisk og menneskelig geografi?


