Hvad er den molære masse af en gas, der tager tre gange længere tid at effuse end helium?
Grahams lov om effusion
Grahams lov siger, at hastigheden for effusion af en gas er omvendt proportional med kvadratroden af dens molære masse. Matematisk:
Sats₁ / rate₂ =√ (m₂ / m₁)
Hvor:
* Sats₁ og sats₂ er hastighederne for udstrømning af gasser henholdsvis 1 og 2
* M₁ og m₂ er de molære masser af gasser 1 og 2, henholdsvis
Anvendelse af loven
1. Identificer de kendte oplysninger:
* Den ukendte gas effuserer tre gange langsommere end helium. Dette betyder, at helgen for helium (hastighed₁) er tre gange hurtigere end hastigheden for den ukendte gas (hastighed₂).
* Den molære masse af helium (M₁) er 4,00 g/mol.
2. Opret ligningen:
Sats₁ / rate₂ =√ (m₂ / m₁)
3 =√ (m₂ / 4,00 g / mol)
3. Løs for den molære masse af den ukendte gas (M₂):
* Kvadrat begge sider af ligningen:9 =m₂ / 4,00 g / mol
* Multiplicer begge sider med 4,00 g/mol:m₂ =36,0 g/mol
Derfor er den molære masse af gassen 36,0 g/mol.
Sidste artikelNår en væske opvarmes, hvad sker der med inter -partikelrum?
Næste artikelHvordan kommer Cardon -dioxid ind i atmosfæren?
 Varme artikler
Varme artikler
-
 Brug af et kraftigt affaldsprodukt:Mod forbedring af køretøjets brændstoføkonomiFint kulfibernetværk fremstillet under optimerede forhold (fra venstre til højre:elektrospundne fibre, termisk stabiliserede fibre kulfiber). Kredit:Kanazawa University I betragtning af bekymringe
Brug af et kraftigt affaldsprodukt:Mod forbedring af køretøjets brændstoføkonomiFint kulfibernetværk fremstillet under optimerede forhold (fra venstre til højre:elektrospundne fibre, termisk stabiliserede fibre kulfiber). Kredit:Kanazawa University I betragtning af bekymringe -
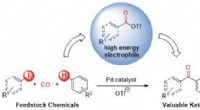 En grønnere måde at lave ketoner påKredit:McGill University Forskere ved McGill University har opdaget en ny, mere miljøvenlig måde at fremstille ketoner på, en vigtig kemisk ingrediens i lægemidler. Mens ketoner findes i en lang r
En grønnere måde at lave ketoner påKredit:McGill University Forskere ved McGill University har opdaget en ny, mere miljøvenlig måde at fremstille ketoner på, en vigtig kemisk ingrediens i lægemidler. Mens ketoner findes i en lang r -
 Supercomputere og Archimedes-princippet gør det muligt at beregne nanoboblediffusion i nukleare bræ…Brændstofældning. Kredit:Daria Sokol/MIPT Forskere fra Moskva Institut for Fysik og Teknologi har foreslået en metode, der fremskynder beregningen af nanoboblediffusion i faste materialer. Denne
Supercomputere og Archimedes-princippet gør det muligt at beregne nanoboblediffusion i nukleare bræ…Brændstofældning. Kredit:Daria Sokol/MIPT Forskere fra Moskva Institut for Fysik og Teknologi har foreslået en metode, der fremskynder beregningen af nanoboblediffusion i faste materialer. Denne -
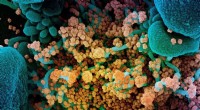 Forskere opdager SARS-CoV-2-hæmmereFarvelagt scanningselektronmikrofotografi af en døende celle (blå) stærkt inficeret med SARS-CoV-2 (gul), virus, der forårsager COVID-19. Kredit:NIAID Integrated Research Facility, Fort Detrick, Maryl
Forskere opdager SARS-CoV-2-hæmmereFarvelagt scanningselektronmikrofotografi af en døende celle (blå) stærkt inficeret med SARS-CoV-2 (gul), virus, der forårsager COVID-19. Kredit:NIAID Integrated Research Facility, Fort Detrick, Maryl
- Et socialt kontrolsystem garanterer embryonale stamcellerenhed
- Evakueringer udvides i Oregon, efterhånden som ilden spreder sig uregelmæssigt
- Hvor mange kromosomer var der i kernen, da mitosen begyndte?
- Hvad er et medium værktøj?
- Hvorfor er væsker og faste stoffer ukomprimerbare?
- Hvordan fremstilles Pinewood?


