Hvorfor er væsker og faste stoffer ukomprimerbare?
1. Intermolekylære kræfter:
* faste stoffer: Molekyler i faste stoffer er tæt pakket og holdes sammen af stærke intermolekylære kræfter (som ioniske bindinger, metalliske bindinger eller stærke van der Waals kræfter). Disse kræfter modstår ethvert forsøg på at skubbe molekylerne tættere sammen.
* væsker: Mens molekyler i væsker har større bevægelsesfrihed sammenlignet med faste stoffer, er de stadig relativt tæt sammen og oplever betydelige intermolekylære kræfter.
2. Densitet:
* Molekylerne i faste stoffer og væsker er meget tættere end i gasser. Dette betyder, at der er meget lidt tomt rum mellem molekyler, hvilket gør det vanskeligt at presse dem nærmere.
3. Kompressibilitet:
* komprimerbarhed er et stofs evne til at falde i volumen under tryk.
* væsker og faste stoffer Har en meget lav kompressibilitet, fordi de stærke intermolekylære kræfter og tæt pakning modstår ændringer i volumen.
* Gasser Har meget svagere intermolekylære kræfter og er mindre tætte, så de er meget mere komprimerbare.
Vigtig note:
Mens vi ofte betragter væsker og faste stoffer, der er ukomprimerbare i hverdagssituationer og nogle beregninger, er de teknisk komprimerbare. Ændringen i volumen er bare ekstremt lille under normalt tryk. Ved ekstremt høje tryk kan selv væsker og faste stoffer imidlertid opleve betydelig komprimering. For eksempel er presset ved Jordens kerne så enormt, at det markant komprimerer jernet og nikkel til stede der.
Sammenfattende skyldes den lave kompressibilitet af væsker og faste stoffer:
* Stærke intermolekylære kræfter, der holder molekylerne sammen.
* Høj densitet, hvilket efterlader meget lidt tomt rum mellem molekyler.
Sidste artikelEr partikler af en gas tæt sammen?
Næste artikelHvordan pakkes væskerpartikler?
 Varme artikler
Varme artikler
-
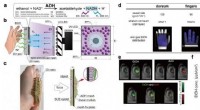 At se det usynlige – Et nyt gasbilleddannelsessystem(a) Detektionsprincip for EtOH baseret på den ADH-medierede katalytiske reaktion. (b) Skematisk diagram af skin-gas-kammen. (c) Arbejdsmekanisme af todimensionel (2D) Mako. (d) Sammenfatning af svedha
At se det usynlige – Et nyt gasbilleddannelsessystem(a) Detektionsprincip for EtOH baseret på den ADH-medierede katalytiske reaktion. (b) Skematisk diagram af skin-gas-kammen. (c) Arbejdsmekanisme af todimensionel (2D) Mako. (d) Sammenfatning af svedha -
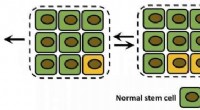 Kemikers beregninger kan fremme forudsigelse af kræftEn skematisk viser en enkelt mutationsfikseringsproces i et vævsrum. Normale stamceller er grønne, og muterede celler er gule. Rice University-forskere brugte en diskret statistisk stokastisk model ti
Kemikers beregninger kan fremme forudsigelse af kræftEn skematisk viser en enkelt mutationsfikseringsproces i et vævsrum. Normale stamceller er grønne, og muterede celler er gule. Rice University-forskere brugte en diskret statistisk stokastisk model ti -
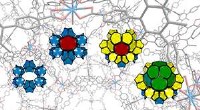 To simple byggeklodser producerer komplekst 3D-materialeSelvmontering af et metal-organisk stel. Kredit:Northwestern University Forskere fra Northwestern University har bygget et strukturelt komplekst materiale fra to simple byggesten, der er den metal
To simple byggeklodser producerer komplekst 3D-materialeSelvmontering af et metal-organisk stel. Kredit:Northwestern University Forskere fra Northwestern University har bygget et strukturelt komplekst materiale fra to simple byggesten, der er den metal -
 Ny proces til konservering af tømmer kan give fordele i forhold til trykbehandlingBehandlede og ubehandlede tømmerstykker nedsænket i vand. Tømmeret til venstre er blevet behandlet ved hjælp af atomlagsaflejring. Det modstår at absorbere vand, selv når det er nedsænket. Til højre e
Ny proces til konservering af tømmer kan give fordele i forhold til trykbehandlingBehandlede og ubehandlede tømmerstykker nedsænket i vand. Tømmeret til venstre er blevet behandlet ved hjælp af atomlagsaflejring. Det modstår at absorbere vand, selv når det er nedsænket. Til højre e
- Hvilken del af Jordens atmosfære eksisterer udelukkende som følge af fotosyntese?
- Forskning demonstrerer ny elektrisk fremdriftsteknologi til rumfartøjer
- Forvandling af stamceller til knogler med nanolerforstærket hydrogel
- Hvad er de 8 økosystemer?
- Hvordan påvirker tilstedeværelsen af cis -dobbeltbindinger i fedtsyrer membranfluiditet?
- Overvåg klimaændringer, ikke rovdyr, for at beskytte sømangfoldigheden


