Hvordan fortsætter frie radikaler forbrænding?
Sådan fungerer de:
1. initiering: Processen starter med dannelsen af frie radikaler. Dette kan ske på grund af høje temperaturer, eksponering for lys eller tilstedeværelsen af en katalysator. I en forbrændingsreaktion bryder varme for eksempel brændstofmolekyler fra hinanden, hvilket skaber frie radikaler.
2. Formering: Når de er dannet, reagerer frie radikaler med andre molekyler, bryder dem fra hinanden og producerer flere frie radikaler i processen. Dette er en kædereaktion, der holder forbrændingen i gang.
3. Opsigelse: Forbrænding stopper til sidst, når frie radikaler støder på hinanden og rekombineres, danner stabile molekyler og afslutter kædereaktionen.
Eksempel:
Lad os overveje forbrænding af metan (CH4) med ilt (O2):
* initiering: Varme bryder O2 -molekylet i to iltfrie radikaler (• O).
* Formering: • O reagerer med CH4 for at danne en methylradikal (• CH3) og en hydroxylradikal (• OH). Disse radikaler reagerer yderligere med O2 og producerer flere radikaler og frigiver energi.
* Opsigelse: Radikalerne støder til sidst på hinanden og rekombinerer og danner stabile molekyler som CO2 og H2O og stopper således forbrændingsprocessen.
Derfor spiller frie radikaler en afgørende rolle i forbrænding ved at indlede en kædereaktion, der forplantes reaktionen, hvilket fører til frigivelse af energi og dannelsen af forbrændingsprodukter.
Vigtig note: Frie radikaler er ikke kun vigtige ved forbrænding. De spiller også en rolle i andre kemiske reaktioner og biologiske processer. I nogle sammenhænge kan de være skadelige og bidrage til aldring og sygdom.
 Varme artikler
Varme artikler
-
 Enzym kan få en nøglerolle i lægemiddeldesign til brystkræft og hjernesygdomKredit:Københavns Universitet I de seneste år, forskere har fokuseret på enzymet TLK2, mistænkes for at spille en hovedrolle i flere sygdomme. En ny undersøgelse foretaget på Københavns Universite
Enzym kan få en nøglerolle i lægemiddeldesign til brystkræft og hjernesygdomKredit:Københavns Universitet I de seneste år, forskere har fokuseret på enzymet TLK2, mistænkes for at spille en hovedrolle i flere sygdomme. En ny undersøgelse foretaget på Københavns Universite -
 Proteinmolekyler i celler fungerer som miniatureantennerEn krystal af et rødt fluorescerende protein placeret i et kombineret instrument bestående af et fluorescensmikroskop og et røntgendiffraktometer. Krystallen lyser rødt, når den belyses af en blå lase
Proteinmolekyler i celler fungerer som miniatureantennerEn krystal af et rødt fluorescerende protein placeret i et kombineret instrument bestående af et fluorescensmikroskop og et røntgendiffraktometer. Krystallen lyser rødt, når den belyses af en blå lase -
 Forskere udvikler ny elektrodestruktur til hel-solid-state sekundært batteriETRI-forskere kigger på en ny type elektrodestruktur til hel-solid-state sekundært batteri. Kredit:Electronics and Telecommunications Research Institute (ETRI) Sydkoreanske forskere har udviklet e
Forskere udvikler ny elektrodestruktur til hel-solid-state sekundært batteriETRI-forskere kigger på en ny type elektrodestruktur til hel-solid-state sekundært batteri. Kredit:Electronics and Telecommunications Research Institute (ETRI) Sydkoreanske forskere har udviklet e -
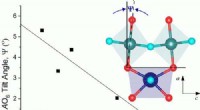 Opbygning af viden om ændringer i urankemiKredit:Australian Nuclear Science and Technology Organisation (ANSTO) Der er stadig rigtig mange spørgsmål, der skal besvares inden for urankemi, især i forbindelse med det nukleare brændselskreds
Opbygning af viden om ændringer i urankemiKredit:Australian Nuclear Science and Technology Organisation (ANSTO) Der er stadig rigtig mange spørgsmål, der skal besvares inden for urankemi, især i forbindelse med det nukleare brændselskreds
- Kunstig intelligens kan hjælpe dig med at beskytte dine personlige data
- Verdens rigeste mand planlægger at begynde at opbygge huse - i rummet
- Kan havet være nøglen til at reducere kuldioxid i atmosfæren?
- Hvad er sammenlåsende krystaller?
- Den seneste vulkanske aktivitet på månen? For bare 100 millioner år siden
- Ikke nu, aldrig nogensinde:Arbejder med vold i hjemmet


