Hvad er egenskaberne ved en stærk base eller syre?
Karakteristika for stærke syrer og baser:
Her er en sammenbrud af de vigtigste egenskaber ved stærke syrer og baser:
Stærke syrer:
* ioniser i vand: Dette betyder, at når en stærk syre opløses i vand, donerer alle dens molekyler en proton (H+) til vandmolekyler, hvilket danner hydroniumioner (H3O+).
* Høj koncentration af H+ -ioner: På grund af komplet ionisering har stærke syrer en meget høj koncentration af brintioner i opløsning, hvilket gør dem meget sure.
* Værdier med lav pH: Stærke syrer har typisk pH -værdier under 1, hvilket indikerer en høj surhedsgrad.
* Eksempler: Hydrochlorsyre (HCI), svovlsyre (H2SO4), salpetersyre (HNO3)
Stærke baser:
* dissocieres helt i vand: Stærke baser, når de opløses i vand, nedbrydes fuldstændigt i deres respektive ioner. Dette inkluderer frigivelse af hydroxidioner (OH-) i opløsningen.
* Høj koncentration af OH-ioner: På grund af komplet dissociation har stærke baser en høj koncentration af hydroxidioner i opløsning, hvilket gør dem meget basale.
* høje pH -værdier: Stærke baser har typisk pH -værdier over 13, hvilket indikerer en høj alkalinitet.
* Eksempler: Natriumhydroxid (NaOH), kaliumhydroxid (KOH), bariumhydroxid (BA (OH) 2)
Nøgleforskelle:
* ionisering vs. dissociation: Stærke syrer ioniserer (donerer protoner), mens stærke baser adskiller sig (frigør hydroxidioner).
* H+ vs. OH-koncentration: Stærke syrer har høje H+ -koncentrationer, mens stærke baser har høje OH-koncentrationer.
Vigtig note: Det er vigtigt at håndtere stærke syrer og baser med ekstrem forsigtighed, da de kan forårsage alvorlige forbrændinger og skader. Brug altid passende sikkerhedsforanstaltninger som handsker og beskyttelsesbriller.
 Varme artikler
Varme artikler
-
 Et fast opløsningsmiddel til unikke materialerSyntese af nyt materiale ved hjælp af et fast opløsningsmiddel. Et substrat dækket med et system af ensartet fordelte ankre nedsænkes i en opløsning indeholdende de ønskede atomer eller molekyler, som
Et fast opløsningsmiddel til unikke materialerSyntese af nyt materiale ved hjælp af et fast opløsningsmiddel. Et substrat dækket med et system af ensartet fordelte ankre nedsænkes i en opløsning indeholdende de ønskede atomer eller molekyler, som -
 Vandmolekyler er guld til nanokatalyseKredit:CC0 Public Domain Nanokatalysatorer lavet af guld nanopartikler spredt på metaloxider er meget lovende for industri, selektiv oxidation af forbindelser, inklusive alkoholer, til værdifulde
Vandmolekyler er guld til nanokatalyseKredit:CC0 Public Domain Nanokatalysatorer lavet af guld nanopartikler spredt på metaloxider er meget lovende for industri, selektiv oxidation af forbindelser, inklusive alkoholer, til værdifulde -
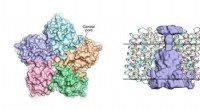 Forskere afslører strukturen af virale rhodopsinerTil venstre:et billede af OLPVRII -pentameren fra den cytoplasmatiske side. Den centrale pore er kontureret af en rød cirkel. Til højre:set fra siden af pentameren. Den centrale pore er farvet lyseb
Forskere afslører strukturen af virale rhodopsinerTil venstre:et billede af OLPVRII -pentameren fra den cytoplasmatiske side. Den centrale pore er kontureret af en rød cirkel. Til højre:set fra siden af pentameren. Den centrale pore er farvet lyseb -
 Et bedre bæredygtigt hygiejnebindSHERO Pad, udviklet af et team af University of Utah materialevidenskab og ingeniørstuderende, er en ny feminin hygiejnepude, der er 100 procent biologisk nedbrydelig og lavet af alle naturlige materi
Et bedre bæredygtigt hygiejnebindSHERO Pad, udviklet af et team af University of Utah materialevidenskab og ingeniørstuderende, er en ny feminin hygiejnepude, der er 100 procent biologisk nedbrydelig og lavet af alle naturlige materi
- Molekylær skala på biologiske membraner
- Er evolution mere intelligent, end vi troede?
- NASA-data hjælper med at opbygge modstandskraft, efterhånden som katastrofer bliver mere intense
- Ny finansiering til forskning i supermateriale grafen
- Amazons Jeff Bezos, allerede den rigeste person på planeten, lige blevet milliarder rigere
- Dark Moon Vs. New Moon


