Hvorfor er PBBR4 og PBI4 ustabile?
1. Forskel mellem stor størrelse mellem fosfor og halogenatomer:
* Fosfor er et relativt lille atom sammenlignet med brom og jod.
* Den store størrelsesforskel mellem fosfor og halogener skaber et betydeligt misforhold i atomradier.
* Denne uoverensstemmelse fører til svage bindingsinteraktioner og gør forbindelserne ustabile.
2. Sterisk hindring:
* De store brom- og jodatomer skaber signifikant sterisk hindring omkring phosphoratomet.
* Denne overfyldning gør det vanskeligt for molekylet at opretholde en stabil geometri.
* Den steriske frastødning svækker obligationerne yderligere og bidrager til ustabilitet.
3. Polariserbarhed af halogenatomer:
* Brom og jod er meget polariserbare atomer, hvilket betyder, at deres elektronskyer let kan forvrænges.
* Denne polariserbarhed kan føre til signifikante interaktioner mellem halogenatomerne, hvilket potentielt får molekylet til at nedbrydes.
4. Mangel på en stabil oxidationstilstand:
* Det er kendt, at fosfor udviser stabile oxidationstilstande på +3 og +5.
* I PBBR 4 og PBI 4 , fosfor er i en formel oxidationstilstand på +4, hvilket er mindre almindeligt og mindre stabilt.
5. Dannelse af mere stabile forbindelser:
* Nedbrydningen af PBBR 4 og PBI 4 fører ofte til dannelse af mere stabile forbindelser, såsom fosforhalogenider med lavere oxidationstilstande (f.eks. PBR 3 , Pi 3 ) eller elementær brom og jod.
I resumé er ustabiliteten af PBBR 4 og PBI 4 stammer fra en kombination af faktorer relateret til størrelse misforhold, sterisk hindring, polariserbarhed og manglen på en stabil oxidationstilstand for fosfor. Disse faktorer bidrager til svage bindingsinteraktioner og fremmer dannelsen af mere stabile forbindelser.
Sidste artikelHvor stammer heliumgas?
Næste artikelHvad er nogle eksempler på kemisk reaktion i miljøet?
 Varme artikler
Varme artikler
-
 3-D-printede væv kan holde atleter i aktionRice University-studerende Sean Bittner har en prøve af et 3D-printet stillads, der en dag kan hjælpe med at helbrede osteochondrale skader af den slags, som atleter ofte lider af. Materialet efterlig
3-D-printede væv kan holde atleter i aktionRice University-studerende Sean Bittner har en prøve af et 3D-printet stillads, der en dag kan hjælpe med at helbrede osteochondrale skader af den slags, som atleter ofte lider af. Materialet efterlig -
 Forskere ser på måder at forbedre standard bremsesystemer påUBCO School of Engineering-forsker Mohammad Arjmand undersøger den nye polymerbaserede bremseklods, som kan revolutionere bremsesystemer i biler og tog. Kredit:UBC Okanagan Selvom det ikke er et s
Forskere ser på måder at forbedre standard bremsesystemer påUBCO School of Engineering-forsker Mohammad Arjmand undersøger den nye polymerbaserede bremseklods, som kan revolutionere bremsesystemer i biler og tog. Kredit:UBC Okanagan Selvom det ikke er et s -
 Find de faktorer, der påvirker stålkorrosionen mest i armeret beton mestMercedes Sánchez, undersøgelse af undersøgelsen. Kredit:Universidad de Córdoba Siden de egyptiske pyramider og det romerske Colosseum blev bygget, menneskeheden har ledt efter en overkommelig pris
Find de faktorer, der påvirker stålkorrosionen mest i armeret beton mestMercedes Sánchez, undersøgelse af undersøgelsen. Kredit:Universidad de Córdoba Siden de egyptiske pyramider og det romerske Colosseum blev bygget, menneskeheden har ledt efter en overkommelig pris -
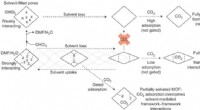 Kontinuerlig åndbar metal-organisk ramme med gæsteselektivitetForeslået rolle for gæst-ramme-interaktioner i de opløsningsmiddelafhængige kontinuerlige vejrtrækningsegenskaber af SHF-61. Kredit:(c) Naturkemi (2017). DOI:10.1038/nchem.2747 (Phys.org) —Forsk
Kontinuerlig åndbar metal-organisk ramme med gæsteselektivitetForeslået rolle for gæst-ramme-interaktioner i de opløsningsmiddelafhængige kontinuerlige vejrtrækningsegenskaber af SHF-61. Kredit:(c) Naturkemi (2017). DOI:10.1038/nchem.2747 (Phys.org) —Forsk
- Fysikere justerer dynamikken i eksotiske kvantepartikler
- Clathrin som et bioteknisk substrat:Immobilisering og funktionalisering
- Hvilket studieretning ville være mest nyttigt for en person, der ønsker at dyrke sikre madafgrøde…
- Undersøgelse undersøger, hvordan risikotolerance ændrer sig omkring lønningsdagen
- Kan et flydende væskelignende materiale bevare sin strukturelle orden som krystaller?
- Hvordan påvirker trykket Plate Tectonics?


