Hvilke målinger skal foretages beregne diffusionshastigheden en gas?
Forståelse af diffusion
Diffusion er bevægelsen af partikler fra et område med høj koncentration til et område med lav koncentration. For gasser sker dette, fordi molekyler er i konstant tilfældig bevægelse, kolliderer og spreder sig.
faktorer, der påvirker gasdiffusion
Gasdiffusionshastigheden påvirkes af flere faktorer:
* Koncentrationsgradient: Jo større forskellen i koncentration mellem to områder, jo hurtigere er diffusionen.
* Temperatur: Højere temperaturer betyder hurtigere partikelbevægelse, hvilket fører til hurtigere diffusion.
* molekylær masse: Lysere gasmolekyler diffunderer hurtigere end tungere.
* Afstand: Diffusion bremser, når den afstand, som molekylerne har brug for, øges.
Målinger til beregning af diffusionshastighed
1. Koncentration:
* indledende koncentration: Mål koncentrationen af gassen i startområdet (høj koncentration).
* slutkoncentration: Mål koncentrationen af gassen i slutområdet (lav koncentration) efter et specifikt tidsinterval.
2. Tid:
* Tidsinterval: Registrer den nøjagtige tidsperiode, som du måler ændringen i koncentration.
3. Afstand:
* Diffusionsafstand: Mål afstanden Gasmolekylerne bevæger sig fra det høje koncentrationsområde til det lave koncentrationsområde.
4. Temperatur:
* Temperatur: Mål systemets temperatur.
Beregninger og almindelige metoder
* Fick's Law of Diffusion: Dette er en grundlæggende lov, der beskriver diffusion:
* diffusionshastighed =-d * (dc/dx)
* Hvor:
* D =diffusionskoefficient (afhænger af gassen og mediet)
* DC/DX =koncentrationsgradient (ændring i koncentration over afstand)
* Det negative tegn indikerer, at diffusion bevæger sig fra høj til lav koncentration.
* Eksperimentelle metoder:
* diffusionscelle: Et specialiseret apparat med to rum adskilt af en barriere. Gassen diffunderer gennem barrieren, og du måler koncentrationsændringerne i hvert rum over tid.
* gaskromatografi: Denne teknik kan adskille forskellige gaskomponenter i en blanding, så du kan måle deres individuelle diffusionshastigheder.
vigtige noter
* enheder: Vær i overensstemmelse med dine enheder. For eksempel kan koncentration være i mol pr. Liter (mol/L), tid på få sekunder (r) og afstand i centimeter (cm).
* Diffusionskoefficient: At finde diffusionskoefficienten (D) kræver enten en opslagstabel for kendte gasser eller specifik eksperimentering for at bestemme den.
Fortæl mig, hvis du har et specifikt scenario i tankerne, og jeg kan give mere skræddersyet vejledning!
Sidste artikelForårsager rivepapir i strimler en kemisk reaktion?
Næste artikelHvad er produktet i Haber -processen?
 Varme artikler
Varme artikler
-
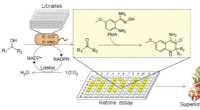 Ny high-throughput screeningsmetode udviklet til ketonerFlowdiagram over PMA-ketonfluorescensscreening. Kredit:Prof. SUN Zhoutongs gruppe Ketoner er af stor betydning som byggesten i syntetisk organisk kemi og biokatalyse. De fleste ketoner kan ikke le
Ny high-throughput screeningsmetode udviklet til ketonerFlowdiagram over PMA-ketonfluorescensscreening. Kredit:Prof. SUN Zhoutongs gruppe Ketoner er af stor betydning som byggesten i syntetisk organisk kemi og biokatalyse. De fleste ketoner kan ikke le -
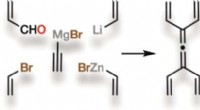 Anstrengt, symmetrisk, og nyt:Tetravinylallen, et lille, men kraftfuldt molekyle, er blevet syntetis…Kredit:Wiley Mange naturlige forbindelser, der bruges i medicin, har komplekse molekylære arkitekturer, som er svære at genskabe i laboratoriet. Hjælp kunne komme fra et lille kulbrintemolekyle, k
Anstrengt, symmetrisk, og nyt:Tetravinylallen, et lille, men kraftfuldt molekyle, er blevet syntetis…Kredit:Wiley Mange naturlige forbindelser, der bruges i medicin, har komplekse molekylære arkitekturer, som er svære at genskabe i laboratoriet. Hjælp kunne komme fra et lille kulbrintemolekyle, k -
 Madoliebelægning forhindrer bakterier i at vokse på fødevareforarbejdningsudstyrDr. Tarek Awad, en forsker ved University of Torontos Department of Materials Science &Engineering, viser to eksempler:til venstre, en rustfri ståloverflade behandlet for at fange simpel madolie, og t
Madoliebelægning forhindrer bakterier i at vokse på fødevareforarbejdningsudstyrDr. Tarek Awad, en forsker ved University of Torontos Department of Materials Science &Engineering, viser to eksempler:til venstre, en rustfri ståloverflade behandlet for at fange simpel madolie, og t -
 Genanvendelig bioplastisk membran til at fjerne oliespild fra vandDen hybride forskningsgruppe, der kombinerer personale fra et forskningsuniversitet (University of Groningen) og et anvendt universitet (NHL Stenden). Medlemmer er (fra venstre mod højre) Katja Loos,
Genanvendelig bioplastisk membran til at fjerne oliespild fra vandDen hybride forskningsgruppe, der kombinerer personale fra et forskningsuniversitet (University of Groningen) og et anvendt universitet (NHL Stenden). Medlemmer er (fra venstre mod højre) Katja Loos,
- Hvad er en carbonhydridkæde?
- Computing med molekyler:Et stort skridt inden for molekylær spintronik
- At give ilt til spørgsmålet om luftkvalitet
- Undersøgelse udforsker virkningerne af arktisk opvarmning på daglige vejrmønstre i USA
- Kan en standby-etiket reducere strømforbruget?
- Forskere simulerer kompakt fusionskraftværks koncept


