Er SiO4 polær eller ikke polær?
* struktur: Den grundlæggende silikatenhed, SiO4, er en tetrahedral struktur med et siliciumatom i midten og fire iltatomer i hjørnerne.
* Elektronegativitet: Oxygen er mere elektronegativ end silicium, hvilket betyder, at det tiltrækker elektroner stærkere. Dette skaber polære bindinger mellem silicium og ilt inden for tetrahedronen.
* symmetri: På grund af den tetrahedrale form og det symmetriske arrangement af de polære bindinger, annullerer de individuelle bindingspolariteter hinanden. Dette resulterer i en ikke -polær molekyle generelt.
Vigtig note: Mens SiO4 i sig selv er ikke -polær, kan den måde, den danner større strukturer (som kæder, lagner og netværk), føre til en vis grad af polaritet afhængigt af det specifikke arrangement af SiO4 -enhederne.
Sidste artikelObligationer, hvor elektroner er lige så delt?
Næste artikelHvad er væsken i en vakuol?
 Varme artikler
Varme artikler
-
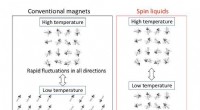 Fra rigelige kulbrinter til sjældne spinvæskerFig. 1 Forskelle mellem almindelige magneter og centrifugeringsvæsker. Ved høje temperaturer, spinnene - de små kompasser for hver uparret elektron i materialerne - svinger tilfældigt mellem vilkårlig
Fra rigelige kulbrinter til sjældne spinvæskerFig. 1 Forskelle mellem almindelige magneter og centrifugeringsvæsker. Ved høje temperaturer, spinnene - de små kompasser for hver uparret elektron i materialerne - svinger tilfældigt mellem vilkårlig -
 Lille enhed tager et stort skridt inden for ikke-invasiv føtal blodprøveteknologiUniversity of South Australia forsker Dr. Marnie Winter. En lille mikrofluidisk enhed, der kan adskille moder- og føtale celler, er ved at blive udviklet til at opdage genetiske abnormiteter i den
Lille enhed tager et stort skridt inden for ikke-invasiv føtal blodprøveteknologiUniversity of South Australia forsker Dr. Marnie Winter. En lille mikrofluidisk enhed, der kan adskille moder- og føtale celler, er ved at blive udviklet til at opdage genetiske abnormiteter i den -
 Forstå, hvad der gør sort pigment sortKredit:CC0 Public Domain Forskere har for første gang ublandet det sorte pigment, der farver vores hud og giver bananerne deres pletter. Forskere ved Ohio State University udførte arbejdet med eu
Forstå, hvad der gør sort pigment sortKredit:CC0 Public Domain Forskere har for første gang ublandet det sorte pigment, der farver vores hud og giver bananerne deres pletter. Forskere ved Ohio State University udførte arbejdet med eu -
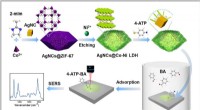 Ny SERS-sensor hjælper med at detektere aldehydgasserSkematisk illustration af den syntetiske rute for AgNCs@Co-Ni LDH og procedure til SERS-påvisning af sporbenzaldehyd. Kredit:XU Di Prof. Huang Qings gruppe fra Hefei Institutes of Physical Science
Ny SERS-sensor hjælper med at detektere aldehydgasserSkematisk illustration af den syntetiske rute for AgNCs@Co-Ni LDH og procedure til SERS-påvisning af sporbenzaldehyd. Kredit:XU Di Prof. Huang Qings gruppe fra Hefei Institutes of Physical Science
- Billede:Lille genstand spottet, der kredser om 67P/Churyumov-Gerasimenko
- Hvorfor klimaændringer får nogle til at springe over at få børn
- Appen Clapping Music afslører, at det ikke er så nemt at ændre rytme
- Blæk med tinnanopartikler kunne udskrive fremtidige printkort
- Kemisk løsning brugt på hospitaler til at dræbe bakterier?
- Hvad er vigtige anvendelser af svovlsyre i tekstilindustrien?


