Hjælper Waters Polarity det som et universelt opløsningsmiddel?
* Polaritet forklaret: Vandmolekyler har en bøjet form på grund af iltatomets højere elektronegativitet end hydrogenatomerne. Dette skaber en delvis negativ ladning nær ilt og delvis positive ladninger nær hydrogenerne. Denne ujævne fordeling af ladning gør vand til et polært molekyle.
* hvordan polaritet hjælper:
* opløste ioniske forbindelser: Vand kan let opløse ioniske forbindelser (som salt, NaCl). Den positive ende af et vandmolekyle tiltrækker den negativt ladede chloridion (CL-), mens den negative ende tiltrækker det positivt ladede natriumion (Na+). Denne interaktion bryder de ioniske bindinger og tillader, at ionerne er omgivet af vandmolekyler, hvilket effektivt opløses saltet.
* opløste polære molekyler: Vand kan også opløse andre polære molekyler som sukker (C12H22O11). De delvise ladninger i vand interagerer med de delvise ladninger i sukkermolekylet, danner brintbindinger og får sukkeret til at opløses.
Det er dog vigtigt at bemærke, at:
* ikke et ægte universelt opløsningsmiddel: Mens vand er et meget godt opløsningsmiddel, opløses det ikke *alt *. Det kan ikke opløse ikke -polære stoffer som olier og fedt, der afvises af vandets polaritet.
* Andre faktorer: Vands opløsningsmiddelegenskaber påvirkes også af andre faktorer som temperatur, tryk og tilstedeværelsen af andre molekyler.
Afslutningsvis er Water's polaritet en nøglefaktor, der gør det til et fremragende opløsningsmiddel for mange stoffer, men ikke et ægte universelt opløsningsmiddel for alle.
 Varme artikler
Varme artikler
-
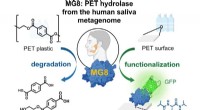 Enzym i menneskelige spytmikrober nedbryder PET-baseret plastKredit:Wiley Menneskespyt kan indeholde et enzym, som kan nedbryde plasten polyethylenterephthalat (PET). Forskere fandt det lovende enzym, en hydrolase, i en database, der indeholder prøver fra me
Enzym i menneskelige spytmikrober nedbryder PET-baseret plastKredit:Wiley Menneskespyt kan indeholde et enzym, som kan nedbryde plasten polyethylenterephthalat (PET). Forskere fandt det lovende enzym, en hydrolase, i en database, der indeholder prøver fra me -
 Oprydning af olieudslipOlie i vand. Kredit:Stock billede, via Carnegie Mellon University, Institut for Kemiteknik Efter tusindvis af liter olie hældt ud i Stillehavet efter udslippet den 2. oktober, agenturer og frivill
Oprydning af olieudslipOlie i vand. Kredit:Stock billede, via Carnegie Mellon University, Institut for Kemiteknik Efter tusindvis af liter olie hældt ud i Stillehavet efter udslippet den 2. oktober, agenturer og frivill -
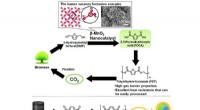 Grønne katalysatorer med jordrige metaller fremskynder produktionen af biobaseret plastUdskiftning af fossilbaseret PET, kendt som råmateriale til sodavandsflasker, med biobaseret PEF bidrager i høj grad til reduktion af CO 2 emissioner. Kredit:Keigo Kamata fra Tokyo Institute of Tech
Grønne katalysatorer med jordrige metaller fremskynder produktionen af biobaseret plastUdskiftning af fossilbaseret PET, kendt som råmateriale til sodavandsflasker, med biobaseret PEF bidrager i høj grad til reduktion af CO 2 emissioner. Kredit:Keigo Kamata fra Tokyo Institute of Tech -
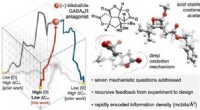 Kemikere udvikler rammer for at muliggøre effektiv syntese af informationstætte molekylerKredit:ACS Et team ledet af forskere ved Scripps Research har udviklet en teoretisk tilgang, der kan lette processen med at gøre meget kompleks, kompakte molekyler. Sådanne molekyler findes ofte
Kemikere udvikler rammer for at muliggøre effektiv syntese af informationstætte molekylerKredit:ACS Et team ledet af forskere ved Scripps Research har udviklet en teoretisk tilgang, der kan lette processen med at gøre meget kompleks, kompakte molekyler. Sådanne molekyler findes ofte
- En solenergi-kvartertælling takket være NASA-borgervidenskab
- Beregningsforudsigelse af, hvor slid vil forekomme i motorer
- Som ikke anses for at være mikroorganismer Helminths b. Svampe c. Bakterier d. Rickettsiae?
- Generering og prøveudtagning af kvantetilstande af lys i en siliciumchip
- Hvor mange liter syre til at dræbe solen?
- Fiskernomader:karper ved Kinas Thousand Island Lake


