Hvorfor tror du, at vand er det universelle opløsningsmiddel?
* Polaritet: Vandmolekyler er polære, hvilket betyder, at de har en lidt positiv ende (brint) og en lidt negativ ende (ilt). Dette gør det muligt for vand at interagere med og opløse andre polære molekyler, som salte og sukker.
* Hydrogenbinding: Vandmolekyler danner stærke hydrogenbindinger med hinanden, hvilket også bidrager til dens evne til at opløse polære molekyler.
* Høj dielektrisk konstant: Vand har en høj dielektrisk konstant, hvilket betyder, at det svækker de elektrostatiske kræfter mellem ioner i et opløst stof, hvilket gør det lettere for dem at adskille og opløses.
Vand opløses dog ikke alt:
* ikke -polære molekyler: Vand er et dårligt opløsningsmiddel for ikke -polære molekyler som olier og fedt. Disse molekyler mangler ladningsadskillelse, der giver dem mulighed for at interagere med vandets polære molekyler.
* Nogle ioniske forbindelser: Visse ioniske forbindelser, som sølvchlorid, er meget dårligt opløselige i vand.
Derfor er vand et godt opløsningsmiddel for mange ting, men ikke alt. Det er mere nøjagtigt at sige, at vand er et alsidigt opløsningsmiddel snarere end et universelt.
 Varme artikler
Varme artikler
-
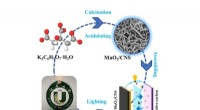 Carbon nanoark som en kompetent assistent til mangandioxid viser bemærkelsesværdig ydeevne i super…Kredit:Higher Education Press I forbindelse med kulstofneutralitet har superkondensatorer, som en ny grøn energilagringsenhed, vist fordele såsom hurtig opladning og afladning, høj effekttæthed og
Carbon nanoark som en kompetent assistent til mangandioxid viser bemærkelsesværdig ydeevne i super…Kredit:Higher Education Press I forbindelse med kulstofneutralitet har superkondensatorer, som en ny grøn energilagringsenhed, vist fordele såsom hurtig opladning og afladning, høj effekttæthed og -
 Opbygning af et bedre batteri med maskinlæringKredit:CC0 Public Domain At designe de bedste molekylære byggesten til batterikomponenter er som at prøve at skabe en opskrift på en ny slags kage, når du har milliarder af potentielle ingrediense
Opbygning af et bedre batteri med maskinlæringKredit:CC0 Public Domain At designe de bedste molekylære byggesten til batterikomponenter er som at prøve at skabe en opskrift på en ny slags kage, når du har milliarder af potentielle ingrediense -
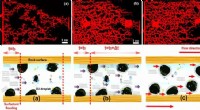 En ny klasse af forgrenede enkeltkædede overfladeaktive stoffer til forbedret olieudvinding rapport…Øverst:Forskelle i bevægelsen af olie gennem mikrokanalerne efter opløsningens oversvømmelse af (a) ren saltlage, b) rent overfladeaktivt stof og (c) overfladeaktivt middel-saltvand. Nederst:Skemati
En ny klasse af forgrenede enkeltkædede overfladeaktive stoffer til forbedret olieudvinding rapport…Øverst:Forskelle i bevægelsen af olie gennem mikrokanalerne efter opløsningens oversvømmelse af (a) ren saltlage, b) rent overfladeaktivt stof og (c) overfladeaktivt middel-saltvand. Nederst:Skemati -
 Ny teori kan føre til bedre batterier, brændstofcellerPå dette billede, forskellige farver repræsenterer den krystallografiske orientering af mikrometerstore korn, der udgør et materiale kaldet Yttria Stabilized Zirconia, bruges i brændselsceller og andr
Ny teori kan føre til bedre batterier, brændstofcellerPå dette billede, forskellige farver repræsenterer den krystallografiske orientering af mikrometerstore korn, der udgør et materiale kaldet Yttria Stabilized Zirconia, bruges i brændselsceller og andr
- Polymer lyser reversibelt hvidt, når det strækkes
- Er der bjerge i den arktiske cirkel?
- Hvordan adskilles olie og vand?
- Et fremskridt inden for molekylær filmproduktion viser, hvordan molekyler reagerer på to fotoner a…
- Klimaændringer vil reducere afgrødeudbyttet:undersøgelse
- Rekordstore temperaturer er mere sandsynlige i befolkede troper


