Hvorfor kendes vand kendt som universelt opløsningsmiddel?
1. Polaritet:
* vandmolekyler er polære: De har en lidt positiv ende (nær hydrogenatomerne) og en lidt negativ ende (nær iltatomet). Denne polaritet giver vand mulighed for at interagere med både positivt og negativt ladede ioner og molekyler.
2. Hydrogenbinding:
* Stærke brintbindinger: Vandmolekyler danner stærke brintbindinger med hinanden og med andre polære molekyler. Dette gør det muligt for vand at trække de bindinger, der holder ioniske forbindelser sammen, opløste dem.
3. Høj dielektrisk konstant:
* Vands høje dielektriske konstant: Vand svækker de elektrostatiske kræfter mellem ioner, hvilket gør det lettere for dem at adskille og opløses.
4. Samhørighed og vedhæftning:
* sammenhængende og klæbende egenskaber: Vandmolekyler tiltrækkes af hinanden (samhørighed) og til andre stoffer (vedhæftning). Disse egenskaber gør det muligt for vand at trænge ind i rummet og interagere med molekyler.
Eksempler på vandets solvens:
* salt (NaCl): Vand opløses salt ved at omringe natrium- og chloridioner med dets polære molekyler og trække dem fra hinanden.
* sukker (C12H22O11): Vand opløses sukker ved at danne hydrogenbindinger med sukkermolekylerne, hvilket svækker bindingerne i sukkerstrukturen.
* ilt og kuldioxid: Mens de er mindre opløselige, opløses disse gasser stadig i vand, afgørende for akvatiske liv.
Vigtig note: Ikke alt opløses i vand. Stoffer som fedt og olier er ikke -polære og opløses ikke let i vand.
Kortfattet: Vands unikke egenskaber ved polaritet, hydrogenbinding, høj dielektrisk konstant og sammenhængende/klæbende kræfter gør det til et kraftfuldt opløsningsmiddel for en lang række stoffer, hvilket tjener det til titlen "universelt opløsningsmiddel."
Sidste artikelHvad er det universelle opløsningsmiddel i biokemi?
Næste artikelHvorfor tror du, at vand er det universelle opløsningsmiddel?
 Varme artikler
Varme artikler
-
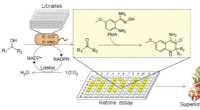 Ny high-throughput screeningsmetode udviklet til ketonerFlowdiagram over PMA-ketonfluorescensscreening. Kredit:Prof. SUN Zhoutongs gruppe Ketoner er af stor betydning som byggesten i syntetisk organisk kemi og biokatalyse. De fleste ketoner kan ikke le
Ny high-throughput screeningsmetode udviklet til ketonerFlowdiagram over PMA-ketonfluorescensscreening. Kredit:Prof. SUN Zhoutongs gruppe Ketoner er af stor betydning som byggesten i syntetisk organisk kemi og biokatalyse. De fleste ketoner kan ikke le -
 Genbrug giver brugt nukleart brændsel nyt formålTil genbrug, brugt nukleart brændsel føres ind i et kemisk behandlingssystem, der adskiller aktinidelementer, der kan genanvendes som blandet oxidbrændsel for at producere mere elektrisk strøm. Hos PN
Genbrug giver brugt nukleart brændsel nyt formålTil genbrug, brugt nukleart brændsel føres ind i et kemisk behandlingssystem, der adskiller aktinidelementer, der kan genanvendes som blandet oxidbrændsel for at producere mere elektrisk strøm. Hos PN -
 Forskere testede med succes nye, sikrere titaniumplade til knoglevævsreparationDenne røde farvesektion viser, at knoglevæv var kommet ind i rummet mellem titaniumfibre, efter at titanfiberpladen blev implanteret. Grøn farve sektion viser, at i uge 4 postoperativt, fuldstændig kn
Forskere testede med succes nye, sikrere titaniumplade til knoglevævsreparationDenne røde farvesektion viser, at knoglevæv var kommet ind i rummet mellem titaniumfibre, efter at titanfiberpladen blev implanteret. Grøn farve sektion viser, at i uge 4 postoperativt, fuldstændig kn -
 Kemiker skaber en effektiv katalysator til syntese af organiske sulfiderKredit:RUDN Universitet En RUDN-kemiker har fået en ny forbindelse - en håndvægt-formet fosfat-brokoblet molybdænklynge. Klyngen accelererer reaktionen af dannelsen af sulfider fra oxider og k
Kemiker skaber en effektiv katalysator til syntese af organiske sulfiderKredit:RUDN Universitet En RUDN-kemiker har fået en ny forbindelse - en håndvægt-formet fosfat-brokoblet molybdænklynge. Klyngen accelererer reaktionen af dannelsen af sulfider fra oxider og k
- En model, der beregner den brøkdel af høstakken, som SETI -programmer samlet har undersøgt
- NASA fanger dannelsen af Atlantics rekordstore 15. tropiske storm
- Billeder viser europæisk Mars-sonde styrtede ned, kan være eksploderet (Opdatering)
- Det mærkelige tilfælde af dykkerfluen
- Gentrificering udløser et fald på 16 procent i bykriminalitet i Cambridge, Massachusetts
- SpaceX-lanceringen markerer 40. pladsen for Space Coast


