Hvordan påvirker temperaturen reaktionshastigheden?
forholdet
* Højere temperatur =hurtigere reaktionshastighed: Generelt fører forøgelse af temperaturen på en reaktionsblanding til en hurtigere reaktionshastighed.
* lavere temperatur =langsommere reaktionshastighed: Omvendt bremser faldende temperaturen reaktionshastigheden.
Hvorfor påvirker temperaturen reaktionshastighed?
1. Øget kinetisk energi: Temperaturen er et mål for den gennemsnitlige kinetiske energi af molekyler. Når temperaturen stiger, bevæger molekyler sig hurtigere og kolliderer oftere.
2. mere effektive kollisioner: Højere kinetisk energi betyder, at molekyler har mere energi til at overvinde aktiveringsenergibarrieren. Denne barriere er den minimale energi, der kræves for reaktanter til at danne produkter. Flere kollisioner med tilstrækkelig energi fører til mere succesrige reaktioner.
3. øget hyppighed af kollisioner: Med højere kinetisk energi bevæger molekyler sig hurtigere og kolliderer oftere. Denne øgede kollisionsfrekvens giver flere muligheder for vellykkede reaktioner.
Kvantitativt forhold:Arrhenius -ligningen
Forholdet mellem temperatur og reaktionshastighed er beskrevet af Arrhenius -ligningen:
k =ae^(-ea/rt)
Hvor:
* k: Rate konstant (et mål for hvor hurtigt reaktionen fortsætter)
* a: Pre-eksponentiel faktor (relateret til hyppigheden af kollisioner)
* ea: Aktiveringsenergi (den minimale energi, der kræves til en reaktion)
* r: Ideel gaskonstant
* t: Absolut temperatur (i Kelvin)
Nøglepunkter
* Temperatur påvirker hastighedskonstanten (K): Højere temperatur betyder en større hastighedskonstant, hvilket indikerer en hurtigere reaktion.
* aktiveringsenergi (EA) forbliver konstant: Temperatur ændrer ikke den mængde energi, der kræves for at starte reaktionen.
* Arrhenius -ligningen hjælper med at forudsige effekten af temperatur: Det giver os mulighed for at beregne, hvor meget hastighedskonstanten ændres med en specifik temperaturændring.
Eksempler
* Madlavning: Fødevarekoger hurtigere ved højere temperaturer, fordi varmen fremskynder de kemiske reaktioner, der er involveret i nedbrydning af molekyler og ændring af deres struktur.
* ild: En brand brænder mere kraftigt i varmere temperaturer, da varmen giver den nødvendige energi til forbrændingsreaktioner.
* enzymer: Enzymer er biologiske katalysatorer, der fremskynder reaktioner i levende organismer. Deres aktivitet er meget temperaturafhængig med optimale temperaturer for deres funktion.
Undtagelser
Mens den generelle regel er, at højere temperatur øger reaktionshastigheden, er der nogle undtagelser:
* reaktioner med komplekse mekanismer: Nogle reaktioner involverer flere trin, og temperaturen kan påvirke forskellige trin forskelligt.
* ligevægtsreaktioner: Effekten af temperatur på ligevægtsreaktioner er kompleks og afhænger af, om reaktionen er eksoterm eller endotermisk.
* Nedbrydningsreaktioner: Nogle nedbrydningsreaktioner bliver langsommere ved højere temperaturer.
Sammenfattende er temperaturen en afgørende faktor, der påvirker hastigheden af kemiske reaktioner. At forstå dette forhold er vigtigt på forskellige områder, fra kemi og biologi til teknik og hverdag.
Sidste artikelHvordan hjælper polonium mennesker?
Næste artikelHvad er de rustende egenskaber ved rustfrit stål 202?
 Varme artikler
Varme artikler
-
 Ny metal-organisk ramme kan optage giftig svovldioxidgasIllustration af svovldioxid fanget i MFM-170-materialet, som afsløret af eksperimenter ved Berkeley Labs Advanced Light Source. Kredit:Gemma Smith/Manchester University Et internationalt team har
Ny metal-organisk ramme kan optage giftig svovldioxidgasIllustration af svovldioxid fanget i MFM-170-materialet, som afsløret af eksperimenter ved Berkeley Labs Advanced Light Source. Kredit:Gemma Smith/Manchester University Et internationalt team har -
 Upcycling af plastikflasker kunne give dem et mere nyttigt andet livDisse kompositmaterialer, udviklet af upcycling af PET, kan bruges i vindmøller, snowboards, eller materialer som ballistisk nylon og genanvendelige flasker, der kan bruges flere gange, før de genbrug
Upcycling af plastikflasker kunne give dem et mere nyttigt andet livDisse kompositmaterialer, udviklet af upcycling af PET, kan bruges i vindmøller, snowboards, eller materialer som ballistisk nylon og genanvendelige flasker, der kan bruges flere gange, før de genbrug -
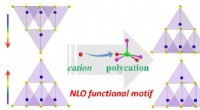 Bredspektrede NLO-materialer opnået ved polykation-substitution-induceret NLO-funktionel motivbesti…Skematisk illustration af rekonstruktion af NLO-funktionelt motiv på en parallel måde via polykation-substitution-induceret CS-til-NCS transformationsstrategi. Kredit:Prof. GUOs gruppe Ikke-lineær
Bredspektrede NLO-materialer opnået ved polykation-substitution-induceret NLO-funktionel motivbesti…Skematisk illustration af rekonstruktion af NLO-funktionelt motiv på en parallel måde via polykation-substitution-induceret CS-til-NCS transformationsstrategi. Kredit:Prof. GUOs gruppe Ikke-lineær -
 Koboltbaserede katalysatorer kunne fremskynde produktionen af brint i industriel skala fra vandKredit:CC0 Public Domain Et billigt og enkelt alternativ til dyre platinbaserede katalysatorer, der genererer brint fra vand, kan snart være tilgængeligt, tak til A*STAR-forskere. Et hold fra A*S
Koboltbaserede katalysatorer kunne fremskynde produktionen af brint i industriel skala fra vandKredit:CC0 Public Domain Et billigt og enkelt alternativ til dyre platinbaserede katalysatorer, der genererer brint fra vand, kan snart være tilgængeligt, tak til A*STAR-forskere. Et hold fra A*S
- Var dinosaurer de mest succesfulde dyr på Jorden?
- Gode manerer, lydighed og uselviskhed:Data afslører, hvordan britiske forældreprioriteter sammen…
- Hvordan Synesthesia virker
- Forskere graver i tilfælde af geologisk amnesi
- Næsten halvdelen af de anklagede chikanere kan vende tilbage på arbejde
- Termisk manipulation af plasmoner i atomisk tynde film


