Hvilken gruppe af elementer på den periodiske tabel er meget reaktive, og hvorfor?
Her er grunden til, at de er så reaktive:
* en valenselektron: Alkalimetaller har kun et elektron i deres yderste skal (Valence Shell). Denne enkelt elektron holdes løst og mistes let, hvilket gør dem ivrige efter at danne en positiv ion (+1 ladning).
* lav ioniseringsenergi: Det kræver meget lidt energi at fjerne denne enkelt valenselektron, hvilket gør dem meget reaktive.
* stor atomradius: Deres store atomradius betyder, at det ydre elektron er langt fra kernen og mindre tæt bundet.
* stærk elektropositiv karakter: Alkalimetaller har en stærk tendens til at miste elektroner og danne positive ioner, hvilket får dem til at reagere let med andre elementer, især ikke -metaller.
Eksempler på alkalimetaller:
* Lithium (Li)
* Natrium (NA)
* Kalium (k)
* Rubidium (RB)
* Cesium (CS)
* Francium (FR)
reaktivitet øges ned i gruppen:
Når du bevæger dig ned ad gruppen, øges reaktiviteten af alkalimetaller. Dette skyldes, at atomradiusen øges, hvilket gør valenselektronen endnu længere væk fra kernen og lettere at fjerne.
Sikkerhedsnotat: Alkalimetaller reagerer voldsomt med vand og luft, så de skal håndteres med ekstrem forsigtighed og opbevares i inerte atmosfærer.
 Varme artikler
Varme artikler
-
 Hærforskning ser på perler for at få spor om forbedring af let rustning til soldaterEn ny letvægtsplast, der er 14 gange stærkere og otte gange lettere (mindre tæt) end stål, kan føre til næste generations militære rustninger. Kredit:University of Buffalo Rund, glat og iriserende
Hærforskning ser på perler for at få spor om forbedring af let rustning til soldaterEn ny letvægtsplast, der er 14 gange stærkere og otte gange lettere (mindre tæt) end stål, kan føre til næste generations militære rustninger. Kredit:University of Buffalo Rund, glat og iriserende -
 Tryk giver den bedste afkølingMCE:magnetoklaorisk effekt; ECE:elektrokalorisk effekt; eCE:elastokalorisk effekt; BCE:barokalorisk effekt. Plastkrystallerne identificeret i dette arbejde er neopentylglycol (NPG), pentaglycerin (PG)
Tryk giver den bedste afkølingMCE:magnetoklaorisk effekt; ECE:elektrokalorisk effekt; eCE:elastokalorisk effekt; BCE:barokalorisk effekt. Plastkrystallerne identificeret i dette arbejde er neopentylglycol (NPG), pentaglycerin (PG) -
 En ny teknik til at slette enkelte atomer kan fremskynde molekyledesignAsst. Prof. Mark Levin (til venstre) og ph.d. studerende Jisoo Woo på arbejde i laboratoriet på University of Chicago. Kredit:Jason Thome Hver gang der annonceres et nyt kræftlægemiddel, repræsente
En ny teknik til at slette enkelte atomer kan fremskynde molekyledesignAsst. Prof. Mark Levin (til venstre) og ph.d. studerende Jisoo Woo på arbejde i laboratoriet på University of Chicago. Kredit:Jason Thome Hver gang der annonceres et nyt kræftlægemiddel, repræsente -
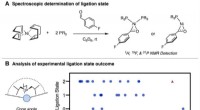 Forudsigelse af fosfinreaktivitet med en simpel metrik%Vbur (min) deskriptoren er unikt i stand til at forudsige spektroskopisk ligeringstilstandsudfald, afslører reaktivitetsklipper i organometallisk kemi. Kredit:Doyle Lab Fosfiner er blandt de vigt
Forudsigelse af fosfinreaktivitet med en simpel metrik%Vbur (min) deskriptoren er unikt i stand til at forudsige spektroskopisk ligeringstilstandsudfald, afslører reaktivitetsklipper i organometallisk kemi. Kredit:Doyle Lab Fosfiner er blandt de vigt


