Hvilke forbindelser giver det højeste smeltepunkt C2H6 CL2 ASCL3 NE VER?
Forståelse af smeltepunkt
Smeltepunkt er den temperatur, hvormed en solid overgår til en væske. Jo stærkere de intermolekylære kræfter holder molekylerne sammen, jo højere er smeltepunktet.
Intermolekylære kræfter
* London Dispersion Forces: Til stede i alle molekyler, men svageste. Forøg med molekylær størrelse.
* dipol-dipol-kræfter: Forekommer mellem polære molekyler (molekyler med ujævn elektronfordeling). Stærkere end London -spredningskræfter.
* Hydrogenbinding: En speciel type dipol-dipolinteraktion, der involverer hydrogen bundet til et stærkt elektronegativt atom (som ilt, nitrogen eller fluor). Den stærkeste type intermolekylær kraft.
analyse af forbindelserne
* C2H6 (ethan): Ikke -polære, kun London -spredningskræfter.
* cl2 (klor): Ikke -polære, kun London -spredningskræfter.
* ascl3 (arsenisk trichlorid): Polar, har dipol-dipolstyrker (og svagere London-spredningskræfter).
* ne (neon): En ædel gas, kun meget svage London -spredningskræfter.
* ver (ikke en kendt forbindelse): Vi kan ikke vurdere dette.
Bestemmelse af det højeste smeltepunkt
* ascl3 vil have det højeste smeltepunkt, fordi det har de stærkeste intermolekylære kræfter (dipol-dipol).
Kortfattet:
Forbindelsen med det højeste smeltepunkt er ASCL3 (arsenisk trichlorid) på grund af dens polære natur og tilstedeværelsen af dipol-dipol-interaktioner.
Sidste artikelHvordan er industriel koks lavet?
Næste artikelEr der en mol vandmolekyler på jorden?
 Varme artikler
Varme artikler
-
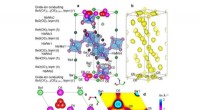 Nye materialer med høj ilt-ion-ledningsevne åbner en bæredygtig fremtidEksperimentelt bevis for den interstitielle oxygen O5 og O1-O5 oxid-ion-interstitialitet diffusion af Ba7Nb3.9Mo1.1O20.05 ved en høj temperatur på 800 oC. Kredit:Tokyo Institute of Technology Fors
Nye materialer med høj ilt-ion-ledningsevne åbner en bæredygtig fremtidEksperimentelt bevis for den interstitielle oxygen O5 og O1-O5 oxid-ion-interstitialitet diffusion af Ba7Nb3.9Mo1.1O20.05 ved en høj temperatur på 800 oC. Kredit:Tokyo Institute of Technology Fors -
 Pigmenter i oliemalerier forbundet med nedbrydning af kunstværkerForskere fra Brookhaven Lab og The Met er vist på beamline 5-ID på NSLS-II, hvor de analyserede en mikroskopisk prøve fra dette oliemaleri fra det 15. århundrede. Kredit:Brookhaven National Laboratory
Pigmenter i oliemalerier forbundet med nedbrydning af kunstværkerForskere fra Brookhaven Lab og The Met er vist på beamline 5-ID på NSLS-II, hvor de analyserede en mikroskopisk prøve fra dette oliemaleri fra det 15. århundrede. Kredit:Brookhaven National Laboratory -
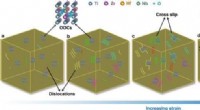 Forbedret styrke og duktilitet i en legering med høj entropi via bestilte iltkomplekserSkematisk diagram, der illustrerer mekanismen for plastisk deformation i den kubiske struktur af den iltrige high-entropy legering (HEA). a) I de ilt-høje entropylegeringer, de bestilte iltkomplekser
Forbedret styrke og duktilitet i en legering med høj entropi via bestilte iltkomplekserSkematisk diagram, der illustrerer mekanismen for plastisk deformation i den kubiske struktur af den iltrige high-entropy legering (HEA). a) I de ilt-høje entropylegeringer, de bestilte iltkomplekser -
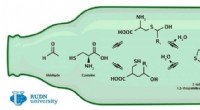 Kemiker foreslår en måde at måle smagen af øl påKredit:RUDN Universitet En kemiker fra RUDN University har udviklet en metode til at analysere produkterne fra binding af aldehyder med aminosyren cystein i malt og øl – disse stoffer kan påvirke
Kemiker foreslår en måde at måle smagen af øl påKredit:RUDN Universitet En kemiker fra RUDN University har udviklet en metode til at analysere produkterne fra binding af aldehyder med aminosyren cystein i malt og øl – disse stoffer kan påvirke
- Hvad vil afgøre, om en klippe bliver en stødende eller metamorfisk klippe?
- Effektiv generering af fotonpar fra modificerede kulstof nanorør
- Canada tæller skade efter Fiona; Cuba og Florida forbereder sig på stormen Ian
- Den livstruende tropiske storm Harvey vælter mod Texas
- Hvad menes med loven om infinitesimals?
- 2-D halvledere viste sig at være tæt på den ideelle fraktionelle kvante Hall-platform


