Atomer med otte valenselektroner danner let forbindelser?
* atomer med otte valenselektroner er stabile: Dette er sandt takket være Octet -reglen. At have en fuld ydre skal af otte elektroner gør dem meget ureaktive.
* de danner ikke let forbindelser: Da de allerede er stabile, reagerer de ikke let med andre atomer for at danne forbindelser. Ædle gasser, som helium (He), Neon (NE) og Argon (AR), er de vigtigste eksempler på dette. De findes som enkeltatomer og er meget ureaktive.
Der er dog et par undtagelser:
* Nogle elementer i p-blokken kan danne forbindelser: Elementer som ilt (O) og svovl (er) kan have mere end otte valenselektroner i nogle forbindelser. Dette skyldes tilstedeværelsen af udvidede oktetter, hvor valenselektronerne kan besætte D-orbitaler.
* elementer kan få eller miste elektroner: Nogle elementer kan vinde eller miste elektroner for at opnå en fuld ydre skal på otte. Sådan dannes ioniske forbindelser. For eksempel mister natrium (NA) et elektron for at blive Na+, mens klor (CL) får et elektron til at blive Cl-.
Kortfattet: Mens atomer med otte valenselektroner er stabile og mindre tilbøjelige til at danne forbindelser, kan de deltage i reaktioner, især dem, der involverer at udvide okteten eller danne ioniske bindinger.
 Varme artikler
Varme artikler
-
 Forudsigelse af forvrængning og ydeevne af dele fremstillet ved additiv fremstillingKredit:CC0 Public Domain Undersøgelser af de resterende spændinger, der dannes under en additiv fremstillingsproces (AM) har afsløret, at bygningsorienteringen af den del, der produceres, har en
Forudsigelse af forvrængning og ydeevne af dele fremstillet ved additiv fremstillingKredit:CC0 Public Domain Undersøgelser af de resterende spændinger, der dannes under en additiv fremstillingsproces (AM) har afsløret, at bygningsorienteringen af den del, der produceres, har en -
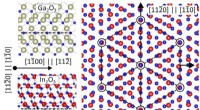 Ny katalytisk effekt fundet til fremstilling af galliumoxidMetaludvekslingskatalyse, som beskrevet, kan producere denne heterostruktur af galliumoxid-indiumoxid til ny elektronik baseret på galliumoxid. Kredit:PDI Halvledende oxider er en ny klasse af mat
Ny katalytisk effekt fundet til fremstilling af galliumoxidMetaludvekslingskatalyse, som beskrevet, kan producere denne heterostruktur af galliumoxid-indiumoxid til ny elektronik baseret på galliumoxid. Kredit:PDI Halvledende oxider er en ny klasse af mat -
 Forbedring af den piezoelektriske mikroskopi karakterisering af keramiske materialerFigur 1:Sidebillede af de to typer anvendte AFM-prober. Den til højre er en ultralang spids, som mindsker den elektrostatiske interaktion mellem udkrageren og prøven. Sammenlignet med standardspidsen,
Forbedring af den piezoelektriske mikroskopi karakterisering af keramiske materialerFigur 1:Sidebillede af de to typer anvendte AFM-prober. Den til højre er en ultralang spids, som mindsker den elektrostatiske interaktion mellem udkrageren og prøven. Sammenlignet med standardspidsen, -
 Fremstilling af åbne mesoporøse carbon nanofibre til fleksible og bærbare strømkilderKredit:CC0 Public Domain Med den nyligt stigende udvikling af letvægts, transportabel, fleksibel og bærbar elektronik til sundheds- og biomedicinsk udstyr, der er et presserende behov for at udfor
Fremstilling af åbne mesoporøse carbon nanofibre til fleksible og bærbare strømkilderKredit:CC0 Public Domain Med den nyligt stigende udvikling af letvægts, transportabel, fleksibel og bærbar elektronik til sundheds- og biomedicinsk udstyr, der er et presserende behov for at udfor
- Skal du bruge en større båd? UMaine har printer til det
- Fiskekampe:Storbritannien har en lang historie med at forbyde adgang til kystnære farvande
- Teknikker lært af jordens klimavidenskabelige bistand i søgningen efter potentielt beboelige exopl…
- Hvordan man laver glycerin fra vegetabilsk olie
- Elastiske og uelastiske kollisioner: Hvad er forskellen? (med eksempler)
- Hvad er en magnetisk switch?


