Hvad sker der med vaskemiddel, når du opløses i vand?
1. Micelledannelse:
* Detergenter er lavet af molekyler med to forskellige dele:
* Hydrofil hoved: Denne del tiltrækkes af vandmolekyler (vandelskende).
* Hydrofob hale: Denne del afvises af vandmolekyler (vandfryd).
* Når vaskemiddel tilsættes til vand, klynger de hydrofobe haler sammen og undgår vandet. De hydrofile hoveder forbliver imidlertid i kontakt med vandet og danner en sfærisk struktur kaldet A micelle .
* Tænk på det som en flok små kugler med en vandelskende ydre skal og en vandhatende kerne.
2. Rengøringshandling:
* fedt og snavs: Fedt og snavs er hydrofob, hvilket betyder, at de ikke blander sig med vand. Dette er grunden til, at sæbe og vand alene ikke er nok til at fjerne dem.
* Micelle Action: De hydrofobe haler af detergentmolekylerne i micellerne fastgøres til fedtet og snavs, der fanger dem inde i micellens kerne.
* emulgering: Micellerne, der nu indeholder fedt og snavs, bliver suspenderet i vandet og skaber en suspension kaldet en emulsion . Dette gør det muligt at skylle snavs væk med vandet.
3. Andre effekter:
* Reduktion af overfladespænding: Rengøringsmidler reducerer overfladespænding af vand, hvilket gør det lettere for vandet at trænge ind i stoffer og løsne snavs.
* spredning af snavs: Micellerne hjælper med at sprede snavspartikler og forhindrer dem i at omdisponere på overfladen rengøres.
Kortfattet:
Når vaskemiddel opløses i vand, danner det miceller, der fanger fedt og snavs, så de kan suspenderes i vandet og skylles væk. Dette er kerneprocessen bag rengøringseffekten af vaskemidler.
Sidste artikelHvilke er de første partikler, der fordampes fra en væske?
Næste artikelHvordan er vandgas tilberedt?
 Varme artikler
Varme artikler
-
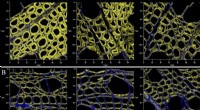 Kvantificering af ændringer i overfladekemi af træplanter under mikrobiel gæringORNL -forskere brugte sofistikerede laserscanningsteknikker til at sammenligne nedbrydningen af fermenteret populær (B) sammenlignet med ugæret populær (A), som de kvantificerede, for første gang, k
Kvantificering af ændringer i overfladekemi af træplanter under mikrobiel gæringORNL -forskere brugte sofistikerede laserscanningsteknikker til at sammenligne nedbrydningen af fermenteret populær (B) sammenlignet med ugæret populær (A), som de kvantificerede, for første gang, k -
 Doping af atleter kan blive sværere at skjule med ny detektionsmetodeKredit:Unsplash/CC0 Public Domain Mens verden venter på de kommende olympiske lege, en ny metode til påvisning af dopingforbindelser i urinprøver kan udjævne spillereglerne for dem, der forsøger a
Doping af atleter kan blive sværere at skjule med ny detektionsmetodeKredit:Unsplash/CC0 Public Domain Mens verden venter på de kommende olympiske lege, en ny metode til påvisning af dopingforbindelser i urinprøver kan udjævne spillereglerne for dem, der forsøger a -
 Forskere opdager en ny mekanisme til at øge styrken og duktiliteten af højentropi-legeringerStress-strain-kurve og dislokationskonfiguration/evolution i MPEAer. (A) er et diagram over DDD-simuleringer for MPEAer. Kredit:Li, Jia et al. Et forskerhold ledet af materialeforskere fra City Uni
Forskere opdager en ny mekanisme til at øge styrken og duktiliteten af højentropi-legeringerStress-strain-kurve og dislokationskonfiguration/evolution i MPEAer. (A) er et diagram over DDD-simuleringer for MPEAer. Kredit:Li, Jia et al. Et forskerhold ledet af materialeforskere fra City Uni -
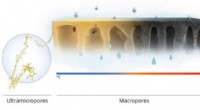 Brændende membraner til molekylær sigtningKredit:King Abdullah University of Science and Technology En robust nanofiltreringsmembran, der fungerer som en yderst effektiv molekylsigte, kan undgå mange af problemerne med nuværende polymermem
Brændende membraner til molekylær sigtningKredit:King Abdullah University of Science and Technology En robust nanofiltreringsmembran, der fungerer som en yderst effektiv molekylsigte, kan undgå mange af problemerne med nuværende polymermem
- Moon Phase Project Ideas
- Græshoppeproblem giver indsigt i kvanteteorien
- Hvilken proces dannede Grandcayon?
- Bredere syn på seksualitet i fængsler, der er nødvendigt for at hjælpe indsatte med at reintegre…
- Hvorfor forvekslede min klassificering bare en skildpadde med en riffel?
- Undersøgelse:Hvordan studerende med forskellig baggrund bruger strategier til at styrke universitet…


