Hvad er en forbindelse, der minimerer ændringer i pH ved reversibelt at optage eller frigive ioner?
Her er hvorfor:
* buffere modstår ændringer i pH: De gør dette ved at neutralisere tilsatte syrer eller baser.
* reversibilitet: Buffere kan donere protoner (H+), når der tilsættes en base eller accepterer protoner, når der tilsættes en syre. Denne reversible proces giver dem mulighed for at opretholde et relativt stabilt pH -område.
Eksempler på buffere:
* bicarbonatbuffer System: Fundet i blod bruger dette system bicarbonationer (HCO3-) og kulsyre (H2CO3) til at opretholde pH.
* phosphatbuffer System: Vigtigt i intracellulære væsker bruger den dihydrogenphosphat (H2PO4-) og monohydrogenphosphat (HPO42-) ioner.
* Tris -buffer: En almindeligt anvendt laboratoriebuffer, Tris (Tris (hydroxymethyl) aminomethan) bruges ofte til biologiske eksperimenter.
Nøglekoncepter:
* Bufferkapacitet: Mængden af syre eller base, som en buffer kan neutralisere, før dens pH ændrer sig markant.
* pka: Den pH, hvor en buffer er mest effektiv. PKA er et kendetegn ved buffersystemet og angiver den pH, hvor bufferen er halvinioniseret og halvprotoneret.
Fortæl mig, hvis du gerne vil udforske nogen af disse aspekter yderligere!
Sidste artikelSubstituerede benzenformer kun en type mono -substitueret produkt?
Næste artikelHvad mener du med ligevægtskonstant?
 Varme artikler
Varme artikler
-
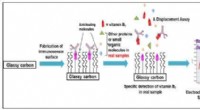 B7 -vitaminovervågningsenhed til analyse af fødevarer og kliniske prøverUdvikling af en elektrokemisk immunosensor til direkte påvisning af vitamin B7 i rigtige prøver. Kredit:Dr. Khor Sook Mei Direkte påvisning af vitamin B7 i ægte prøve er mulig ved hjælp af den udv
B7 -vitaminovervågningsenhed til analyse af fødevarer og kliniske prøverUdvikling af en elektrokemisk immunosensor til direkte påvisning af vitamin B7 i rigtige prøver. Kredit:Dr. Khor Sook Mei Direkte påvisning af vitamin B7 i ægte prøve er mulig ved hjælp af den udv -
 Naturinspireret krystalstruktur forudsigelseForskere fra Rusland fandt en måde at forbedre forudsigelsesalgoritmerne for krystalstruktur, gør opdagelsen af nye forbindelser flere gange hurtigere. Kredit:MIPT Forskere fra Rusland har rappo
Naturinspireret krystalstruktur forudsigelseForskere fra Rusland fandt en måde at forbedre forudsigelsesalgoritmerne for krystalstruktur, gør opdagelsen af nye forbindelser flere gange hurtigere. Kredit:MIPT Forskere fra Rusland har rappo -
 Fysikere forklarer, hvordan store sfæriske vira dannesSiyu Li (til venstre) er kandidatstuderende i laboratoriet hos Roya Zandi, en professor i fysik ved UC Riverside. De ses her holde forskellige icosahedral strukturer. Kredit:I. Pittalwala, UC Riversid
Fysikere forklarer, hvordan store sfæriske vira dannesSiyu Li (til venstre) er kandidatstuderende i laboratoriet hos Roya Zandi, en professor i fysik ved UC Riverside. De ses her holde forskellige icosahedral strukturer. Kredit:I. Pittalwala, UC Riversid -
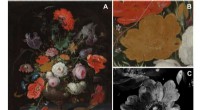 Kemisk og optisk billeddannelse forklarer, hvorfor en rose mistede sin farve i et berømt maleriPigmentnedbrydning i den gule rose i Abraham Mignons Stilleben med blomster og et ur. (A) Visuelt fotografi af stilleben med blomster og et ur af Abraham Mignon (1640-1679), olie på lærred, dateret ca
Kemisk og optisk billeddannelse forklarer, hvorfor en rose mistede sin farve i et berømt maleriPigmentnedbrydning i den gule rose i Abraham Mignons Stilleben med blomster og et ur. (A) Visuelt fotografi af stilleben med blomster og et ur af Abraham Mignon (1640-1679), olie på lærred, dateret ca
- Hvordan bruges videnskab i landbruget?
- Math problemer med positive og negative
- Billeder fra Gemini Observatory afslører slående detaljer om kometen NEOWISE
- Udvikling af verdens første vertikale galliumoxidtransistor gennem ionimplantationsdoping
- Hvad oxytocin kan fortælle os om udviklingen af menneskelig prosocialitet
- En søgen efter stabilitet for platinkatalysatorer


