Vand betragtes som et opløsningsmiddel, fordi?
* Polaritet: Vandmolekyler er polære, hvilket betyder, at de har en lidt positiv ende (brintatomer) og et lidt negativt afslutning (iltatom). Denne polaritet giver vandmolekyler mulighed for at tiltrække og interagere med andre polære molekyler og ioner, bryde dem fra hinanden og opløse dem.
* Hydrogenbinding: Vandmolekyler danner stærke brintbindinger med hinanden og med andre polære molekyler. Denne limning hjælper med at bryde bindingerne i fra hinanden inden for opløsningen og holde opløsningen af opløsningen.
* Høj dielektrisk konstant: Vand har en høj dielektrisk konstant, hvilket betyder, at det effektivt kan reducere de elektrostatiske kræfter mellem ioner, hvilket gør det lettere at opløse ioniske forbindelser.
Kortfattet: Vands polaritet, hydrogenbinding og høj dielektrisk konstant bidrager alle til dets ekstraordinære evne til at opløse en lang række stoffer, hvilket gør det til et kraftfuldt opløsningsmiddel.
Sidste artikelHvad ville du bruge titanium i?
Næste artikelGør acrylonitrile butadiene styren plast, dvs. ABS indeholder bisphenol-A?
 Varme artikler
Varme artikler
-
 Team kombinerer banebrydende modellering med 300-årig statistisk analyseteknik for at forbedre mate…En visualisering af Markov -kæden Monte Carlo -algoritmen, bruges til Bayesiansk analyse, udforske parameterrum. Kredit:Argonne National Laboratory/Noah Paulson På et tidspunkt i dit liv, du har s
Team kombinerer banebrydende modellering med 300-årig statistisk analyseteknik for at forbedre mate…En visualisering af Markov -kæden Monte Carlo -algoritmen, bruges til Bayesiansk analyse, udforske parameterrum. Kredit:Argonne National Laboratory/Noah Paulson På et tidspunkt i dit liv, du har s -
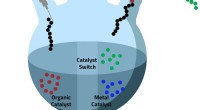 Katalysatorskift betyder, at fire bliver til etVed hjælp af en teknik kaldet katalysatorskift, KAUST -teamet er i stand til at oprette multiblock -polymerer i en enkelt reaktionspotte. © 2019 KAUST Katalysator switch-strategi er nøgletrinnet i
Katalysatorskift betyder, at fire bliver til etVed hjælp af en teknik kaldet katalysatorskift, KAUST -teamet er i stand til at oprette multiblock -polymerer i en enkelt reaktionspotte. © 2019 KAUST Katalysator switch-strategi er nøgletrinnet i -
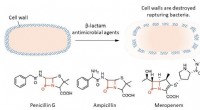 En ny synder i antibakteriel resistens:CysteinpersulfidØverst:β-lactam antimikrobielle midler sprænger bakterier ved at ødelægge deres cellevægge. Nederst:Den røde tekst i strukturformlen repræsenterer β-lactamringen, som er afgørende for bakteriedræbende
En ny synder i antibakteriel resistens:CysteinpersulfidØverst:β-lactam antimikrobielle midler sprænger bakterier ved at ødelægge deres cellevægge. Nederst:Den røde tekst i strukturformlen repræsenterer β-lactamringen, som er afgørende for bakteriedræbende -
 Dekontaminering af mandler og nødder med komprimeret kuldioxidBakteriekulturen udplades i et næringsmedium. Kredit:Karen Fuchs/Fraunhofer UMSICHT Der går næsten ikke en dag, uden at producenter husker mad, der er plettet af urenheder. Selv tørre fødevarer, g
Dekontaminering af mandler og nødder med komprimeret kuldioxidBakteriekulturen udplades i et næringsmedium. Kredit:Karen Fuchs/Fraunhofer UMSICHT Der går næsten ikke en dag, uden at producenter husker mad, der er plettet af urenheder. Selv tørre fødevarer, g
- Burning Man fremhæver det oprindelige menneskelige behov for ritualer
- Afdækning af den hemmelige lov om udviklingen af galaksehobe
- Hvordan klimaændringer gør fjerntliggende indfødte huse til farlige varmekasser
- Apple til lovgivere:Siri lytter ikke, før du bliver bedt om det
- Forskere udvider forståelsen af, hvordan DNA er organiseret
- At bryde igennem grænserne for en enkelt fiber laserforstærker:Kohærent strålekombination


