Hvordan bestemte du den relative atommasse af ilt?
Historisk set involverede bestemmelsen af Oxygen's atommasse en række trin:
1. Definition af en standard: Oprindeligt blev brint valgt som standarden med dens atommasse indstillet til 1. Dette viste sig imidlertid problematisk på grund af Hydrogens tendens til dannelse af isotoper.
2. ilt som standarden: Senere blev ilt standarden, med sin atommasse oprindeligt indstillet til 16. Dette skyldtes forekomsten af ilt i forbindelser og dens relativt stabile isotoper.
3. Moderne standard: Den moderne standard er baseret på carbon-12, der har en atommasse på 12 atommasseenheder (AMU).
4. massespektrometri: Moderne metoder bruger massespektrometri til at bestemme den relative atommasse af elementer. Denne teknik adskiller ioner baseret på deres masse-til-ladningsforhold, hvilket giver forskere mulighed for nøjagtigt at måle masserne af atomer og isotoper.
Nøglepunkter:
* isotoper: Oxygen har flere isotoper (Oxygen-16, Oxygen-17 og Oxygen-18). Den relative atommasse af ilt repræsenterer den gennemsnitlige masse af alle dens naturligt forekommende isotoper under hensyntagen til deres relative forekomst.
* Relativ atommasse: Den relative atommasse er et forhold, der sammenligner massen af et atom af et element til 1/12 af massen af et carbon-12-atom.
* Kontinuerlig forfining: Bestemmelsen af atommasser er en løbende proces, og forskere raffinerer konstant deres målinger ved hjælp af mere præcise teknikker.
Sammenfattende involverede bestemmelsen af Oxygen's relative atommasse at definere en standard, ved hjælp af nøjagtige målingsteknikker som massespektrometri og i betragtning af den relative overflod af dens isotoper.
 Varme artikler
Varme artikler
-
 Farvelægning af hjerteslagHjertesygdomme er en af de førende dødsårsager rundt om i verden. At finde lette tidlige måder at screene efter gode lægemidler er afgørende. Kredit:Kyoto University iCeMS I det 17. århundrede t
Farvelægning af hjerteslagHjertesygdomme er en af de førende dødsårsager rundt om i verden. At finde lette tidlige måder at screene efter gode lægemidler er afgørende. Kredit:Kyoto University iCeMS I det 17. århundrede t -
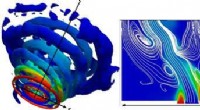 Minimering af ammoniak -brændstofemissionerTil venstre:Vortex strukturer af hvirvlende strømme. Til højre:Blanding af mønster af to ammoniakstrømme med luftstrømmen nær hvirvlerne, placeret i bunden af figuren. Farver angiver fordeling af am
Minimering af ammoniak -brændstofemissionerTil venstre:Vortex strukturer af hvirvlende strømme. Til højre:Blanding af mønster af to ammoniakstrømme med luftstrømmen nær hvirvlerne, placeret i bunden af figuren. Farver angiver fordeling af am -
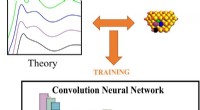 Maskinlæringsanalyse af røntgendata udvælger vigtige katalytiske egenskaberDette skema viser, hvordan spektre afledt af teoriberegninger ved hjælp af kendte strukturer (øverst) kan bruges til at træne et neuralt netværk (i midten), som så kan bruge sin samlede viden til at o
Maskinlæringsanalyse af røntgendata udvælger vigtige katalytiske egenskaberDette skema viser, hvordan spektre afledt af teoriberegninger ved hjælp af kendte strukturer (øverst) kan bruges til at træne et neuralt netværk (i midten), som så kan bruge sin samlede viden til at o -
 Tusindvis af liter godt:LSU -kemikere hjælper Louisiana med at forberede store partier håndspritLSU Ph.D. studerende Anthony Mai og hans rådgiver LSU Chemistry Chair John Pojman hjalp Louisianas udenrigsminister med at formulere tusindvis af liter håndsprit. Kredit:LSU Chemistry Chair John Pojma
Tusindvis af liter godt:LSU -kemikere hjælper Louisiana med at forberede store partier håndspritLSU Ph.D. studerende Anthony Mai og hans rådgiver LSU Chemistry Chair John Pojman hjalp Louisianas udenrigsminister med at formulere tusindvis af liter håndsprit. Kredit:LSU Chemistry Chair John Pojma
- Hvilken type jord har Nebraska?
- Måling af mekaniske spændinger og belastninger i grafenbaserede superkondensatorelektroder
- Forsker diskuterer, hvordan miljøet påvirker den måde, samfund udvikler sig på
- Hvilken type fejl er Rose Canyon Fault?
- Hvad er forskellen mellem regolit og jord?
- Hvor kan man finde information om genpool?


