Hvorfor har elementet med lavest atomnummer største radier i hver periode?
* atomstruktur: Atomer består af en kerne (indeholdende protoner og neutroner) omgivet af elektroner i forskellige energiniveauer (elektronskaller).
* på tværs af en periode: Når du bevæger dig over en periode fra venstre mod højre, øges antallet af protoner i kernen. Denne øgede positive ladning tiltrækker elektronerne stærkere og trækker dem tættere på kernen. Dette resulterer i en mindre atomradius Når du bevæger dig over en periode.
* ned en gruppe: Når du bevæger dig ned ad en gruppe, tilføjer du nye energiniveauer (skaller) til atomet. Disse ydre skaller er længere væk fra kernen, hvilket fører til en større atomradius .
Eksempel:
* periode 2: Lithium (Li) har det mindste atomnummer og den største atomradius i periode 2. Når du bevæger dig til højre, falder radius, med beryllium (BE), bor (B), kulstof (C), nitrogen (N), ilt (O), fluor (F) og neon (NE), der gradvis har mindre radii.
* periode 3: Natrium (NA) har den største atomradius i periode 3, fordi det har det mindste atomnummer.
Kortfattet:
Elementet med det laveste atomnummer i hver periode har den største atomradius, fordi det har færrest protoner i sin kerne, hvilket fører til svagere tiltrækning på elektronerne og en større afstand mellem kernen og den yderste elektronskal.
Sidste artikelElementer i Nobelgasgruppen på periodisk tabel?
Næste artikelHvorfor skal jod vises i gruppe 7 den periodiske tabel?
 Varme artikler
Varme artikler
-
 Manglende atomer i en glemt krystal bringer luminescensPerovskitten har en kraftig grøn fluorescens. Kredit:© 2017 De Bastiani Et lidet undersøgt medlem af perovskitfamilien af materialer kunne finde anvendelse i en række elektroniske enheder, efter
Manglende atomer i en glemt krystal bringer luminescensPerovskitten har en kraftig grøn fluorescens. Kredit:© 2017 De Bastiani Et lidet undersøgt medlem af perovskitfamilien af materialer kunne finde anvendelse i en række elektroniske enheder, efter -
 At dreje det periodiske system gennem 180 grader for et nyt perspektivKredit:University of Nottingham Kunne vende det periodiske system på hovedet gøre nogle vigtige aspekter lettere at forstå og begejstre flere for at studere kemi? Dette spørgsmål stilles i en art
At dreje det periodiske system gennem 180 grader for et nyt perspektivKredit:University of Nottingham Kunne vende det periodiske system på hovedet gøre nogle vigtige aspekter lettere at forstå og begejstre flere for at studere kemi? Dette spørgsmål stilles i en art -
 Belyse spørgsmålet om vinsvindelKredit:University of Adelaide University of Adelaide vinforskere er ved at udvikle en hurtig og enkel metode til at autentificere vin - en potentiel løsning mod den anslåede vinsvindel for milliar
Belyse spørgsmålet om vinsvindelKredit:University of Adelaide University of Adelaide vinforskere er ved at udvikle en hurtig og enkel metode til at autentificere vin - en potentiel løsning mod den anslåede vinsvindel for milliar -
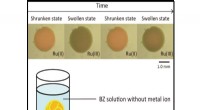 Less is more:En blød, selvbetjent pumpe for at forenkle mekatroniske enhederBelousov-Zhabotinsky hydrogel i opløsning. Kredit:Shibaura Institute of Technology Moderne mekatroniske enheder, fra industrimaskiner til robotter, har set en drastisk stigning i kompleksitet og f
Less is more:En blød, selvbetjent pumpe for at forenkle mekatroniske enhederBelousov-Zhabotinsky hydrogel i opløsning. Kredit:Shibaura Institute of Technology Moderne mekatroniske enheder, fra industrimaskiner til robotter, har set en drastisk stigning i kompleksitet og f
- Angiv trinene til cellecyklen i Order
- AI magic bean kunne spare landmænd for millioner
- Samtidig måling af biofysiske egenskaber og position af enkelte celler i en mikroenhed
- Undersøgelse:Hvordan bier håndterer komplekse farver
- Patent talk:Mobil enhed med solpaneler
- Brug af mobildata til at modellere de schweiziske unges drikkevaner


