Hvilken effekt havde tilsætningen af sukker til bægerglas B og salt C på frysepunktsvand i disse bægerglas?
* frysningspunktdepression: Tilsætningen af opløste stoffer (som sukker eller salt) til et opløsningsmiddel (som vand) sænker opløsningens frysepunkt. Dette fænomen er kendt som frysepunktdepression.
* Forstyrrelse af vandmolekyler: Når sukker eller salt opløses i vand, forstyrrer de opløste molekyler hydrogenbindingen mellem vandmolekyler. Dette gør det vanskeligere for vandmolekylerne at danne den almindelige krystallinske struktur, der er nødvendig til frysning.
* Koncentration betyder noget: Jo mere opløselig du tilføjer (højere koncentration), jo større er frysningspunktdepressionen. Så et bægerglas med meget sukker eller salt vil have et lavere frysepunkt end et med et mindre beløb.
Praktisk eksempel: Derfor salt vi veje om vinteren! Salten opløses i sneen eller isen, sænker frysepunktet og får det til at smelte selv ved temperaturer under 0 ° C (32 ° F).
Sidste artikelHvilken type gas er i Irn Bru?
Næste artikelHvad er de fire vigtigste organiske forbindelser i levende ting?
 Varme artikler
Varme artikler
-
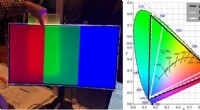 Oprettelse af skærme med rigere farver(Venstre) Foto, der viser farveforbedringseffekten ved brug af en prototype af den perovskitbaserede film. Når filmen placeres mellem baggrundsbelysningsenheden og skærmen, en spektral renere rød og g
Oprettelse af skærme med rigere farver(Venstre) Foto, der viser farveforbedringseffekten ved brug af en prototype af den perovskitbaserede film. Når filmen placeres mellem baggrundsbelysningsenheden og skærmen, en spektral renere rød og g -
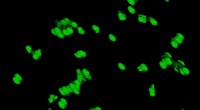 Kostfibre hjælper med at klumpe materiale i din tarmPartikler i tyndtarmsvæsken hos mus ses her i 3D. Musene blev fodret med en standarddiæt. Kredit:Caltech/Ismagilov Lab/A. Preska Steinberg Mad, mikrober, og medicin klumper sig sammen, når de bevæ
Kostfibre hjælper med at klumpe materiale i din tarmPartikler i tyndtarmsvæsken hos mus ses her i 3D. Musene blev fodret med en standarddiæt. Kredit:Caltech/Ismagilov Lab/A. Preska Steinberg Mad, mikrober, og medicin klumper sig sammen, når de bevæ -
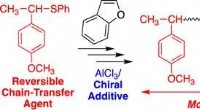 Oprettelse af mere miljøvenlig, varmebestandig og gennemsigtig plastGrafisk abstrakt. Kredit:Journal of the American Chemical Society (2022). DOI:10.1021/jacs.2c02569 Forskere i Japan har udviklet en ny teknik til at skabe polymerer. Denne opdagelse forventes at fø
Oprettelse af mere miljøvenlig, varmebestandig og gennemsigtig plastGrafisk abstrakt. Kredit:Journal of the American Chemical Society (2022). DOI:10.1021/jacs.2c02569 Forskere i Japan har udviklet en ny teknik til at skabe polymerer. Denne opdagelse forventes at fø -
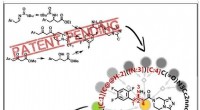 Dette computerprogram gør pharma patenter lufttættehans grafiske abstrakt illustrerer, hvordan ved at identificere og holde styr på vigtige afbrydelser, der er afgørende for patentbeskyttede synteser, et retrosyntetisk computerprogram kan autonomt des
Dette computerprogram gør pharma patenter lufttættehans grafiske abstrakt illustrerer, hvordan ved at identificere og holde styr på vigtige afbrydelser, der er afgørende for patentbeskyttede synteser, et retrosyntetisk computerprogram kan autonomt des
- Kører vand ned ad nanomotorveje
- Spanien ACS lander kontrakt for Toronto letbanelinje
- Forklarer:beviserne for det Tasmanske folkedrab
- Forsker udforsker kontaktfrysning af vand på nanoskala
- Hvad er verdens klimatiske zoner?
- Formålet er at øge elektronikydelsen, forskere tager billeder af sub-nano porestrukturer for førs…


