Hvad er det mest almindelige oxidationsvalensnummer i periodisk tabel?
* Elektronegativitet og binding: Oxidationstilstande tildeles baseret på de relative elektronegativiteter af atomerne involveret i en kemisk binding. Det mere elektronegative atom i en binding tildeles en mere negativ oxidationstilstand.
* forskellige forbindelser: Elementer kan danne en lang række forbindelser, hvilket fører til forskellige oxidationstilstande. For eksempel kan jern eksistere i +2, +3 og endnu højere oxidationstilstande afhængigt af forbindelsen.
* Gruppendenser: Mens der er generelle tendenser i oxidationstilstande inden for grupper af den periodiske tabel, er dette ikke absolutte regler. For eksempel har alkalimetaller (gruppe 1) generelt +1 oxidationstilstande, men nogle kan udvise usædvanlige oxidationstilstande i specifikke forbindelser.
* Overgangsmetaller: Overgangsmetaller er især berygtede for at have flere mulige oxidationstilstande. Dette skyldes tilgængeligheden af D-elektroner til binding.
I stedet for "mest almindelige" er det mere nyttigt at overveje almindelige oxidationstilstande for specifikke grupper eller elementer. Her er nogle eksempler:
* gruppe 1 (alkalimetaller): +1
* gruppe 2 (alkaliske jordmetaller): +2
* gruppe 17 (halogener): -1 (undtagen i forbindelser med ilt, hvor de kan have positive oxidationstilstande)
* ilt: -2 (undtagen i peroxider, hvor det er -1)
* brint: +1 (undtagen i metalhydrider, hvor det er -1)
Husk, at oxidationstilstanden for et element er et nyttigt koncept til forståelse af kemiske reaktioner, men det er ikke en fast egenskab for selve elementet.
Sidste artikelHvad er mængden af partikler i et stof?
Næste artikelHvorfor er vandig opløsning af permanganat ikke helt stabil?
 Varme artikler
Varme artikler
-
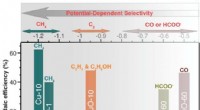 Selektive katalysatorer til kuldioxidgenanvendelseFigur viser, at selektiviteten af Cu-katalysatorer (ved fremstilling af specifikke kulstofbaserede forbindelser) bestemmes af den påførte spænding. Cu-10, CuO-1, CuO-10 og CuO-60 repræsenterer metal
Selektive katalysatorer til kuldioxidgenanvendelseFigur viser, at selektiviteten af Cu-katalysatorer (ved fremstilling af specifikke kulstofbaserede forbindelser) bestemmes af den påførte spænding. Cu-10, CuO-1, CuO-10 og CuO-60 repræsenterer metal -
 Copycat-celler behersker nye kommunikationsevnerMedlemmer af Devaraj Research Group står klar for vejledning fra professor Neal Devaraj (yderst til højre). Kredit:Michelle Fredricks Fra kryptonit til Superman til plantning af toksiner til Poiso
Copycat-celler behersker nye kommunikationsevnerMedlemmer af Devaraj Research Group står klar for vejledning fra professor Neal Devaraj (yderst til højre). Kredit:Michelle Fredricks Fra kryptonit til Superman til plantning af toksiner til Poiso -
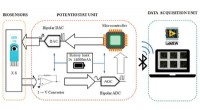 Bluetooth-aktiveret enhed registrerer gæringsprocessen over dageBlokdiagram over multikanalpotentiostaten med seks 3-elektrode biosensorer, der producerer data, der strømmer gennem et printkort og transmitterer trådløst til et LabVIEW-interface ved hjælp af Blueto
Bluetooth-aktiveret enhed registrerer gæringsprocessen over dageBlokdiagram over multikanalpotentiostaten med seks 3-elektrode biosensorer, der producerer data, der strømmer gennem et printkort og transmitterer trådløst til et LabVIEW-interface ved hjælp af Blueto -
 Pesticid, der er dødeligt for bier, kan nu let opdages i honningProfessor Janusz Pawliszyn forvandlede sin græsplæne til en vildblomsteng for at tiltrække bier. Kredit:Janusz Pawliszyn Et almindeligt insekticid, der er en stor fare for honningbier, er nu effek
Pesticid, der er dødeligt for bier, kan nu let opdages i honningProfessor Janusz Pawliszyn forvandlede sin græsplæne til en vildblomsteng for at tiltrække bier. Kredit:Janusz Pawliszyn Et almindeligt insekticid, der er en stor fare for honningbier, er nu effek
- Hvad er Natural Resources Crops Industries i Spanien?
- Bogen beskriver, hvordan den føderale regering brugte bestikkelse til at afslutte forholdet til ind…
- Vandadvarsel i takt med at klimarisici intensiveres:rapport
- Forskere henvender sig til østers som forureningssporende vagtposter
- Hvordan biologi skaber netværk, der er billige, robust, og effektiv
- Forskere foreslår en ny tilgang til effektiv nanomaterialemodellering


