Er gasmolekluger tiltrukket af hinanden?
Ideelle gasser:
* Ingen attraktion: I den ideelle gasmodel antages gasmolekyler ikke at have nogen attraktive kræfter mellem dem. Dette er en forenkling, men det fungerer godt for mange gasser ved relativt lave tryk og høje temperaturer.
Ægte gasser:
* svage attraktioner: Ægte gasser oplever imidlertid svage intermolekylære kræfter. Disse kræfter stammer fra midlertidige udsving i elektronfordeling omkring molekylerne, hvilket fører til midlertidige dipoler. Disse kræfter kaldes London Dispersion Forces og er til stede i alle gasser.
* styrke af tiltrækning: Styrken af disse kræfter afhænger af faktorer som:
* molekylær størrelse: Større molekyler har flere elektroner og stærkere London -spredningskræfter.
* Polaritet: Polære molekyler har permanente dipoler og oplever dipol-dipol-interaktioner, som er stærkere end London-spredningskræfter.
* Temperatur og tryk: Ved lavere temperaturer og højere tryk er molekyler tættere sammen, og de intermolekylære kræfter bliver mere markante.
Eksempler:
* ædle gasser: Helium, neon og argon er eksempler på gasser med meget svage intermolekylære kræfter. De opfører sig næsten som ideelle gasser ved stuetemperatur og tryk.
* diatomiske gasser: Nitrogen, ilt og brint er også relativt ikke -polære og har svage intermolekylære kræfter.
* polære gasser: Vanddamp (H2O) og ammoniak (NH3) har stærkere intermolekylære kræfter på grund af deres polaritet. De afviger mere fra ideel gasadfærd.
Konklusion:
Mens gasmolekyler ikke "tiltrækkes" på samme måde som faste stoffer eller væsker, oplever de svage attraktive kræfter på grund af midlertidige udsving i deres elektronfordeling. Disse kræfter bliver mere markante ved lavere temperaturer og højere tryk, hvilket får reelle gasser til at afvige fra ideel gasadfærd.
Sidste artikelHvilke kemikalier kommer ind og forlader axonet ved knudepunkter af Ranvier?
Næste artikelHvad lavet af aminosyrer?
 Varme artikler
Varme artikler
-
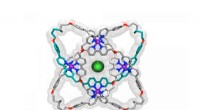 Molekylær knude vinder rekord for verdens strammesteRøntgenkrystalstruktur af en molekylær knude med otte krydsninger. Kredit:Jean-Francois Lemonnier, University of Manchester Forskere ved University of Manchester fejrer efter at være blevet rekord
Molekylær knude vinder rekord for verdens strammesteRøntgenkrystalstruktur af en molekylær knude med otte krydsninger. Kredit:Jean-Francois Lemonnier, University of Manchester Forskere ved University of Manchester fejrer efter at være blevet rekord -
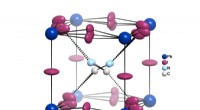 Perovskite solceller:Mulige aspekter af høj effektivitet afdækketTegningen illustrerer vekselvirkningen af den organiske methylammoniumkation (CH3NH3+) med de omgivende iodidioner. Skiftet af iodidatomerne ud af det fælles plan med bly forårsager brud på inversio
Perovskite solceller:Mulige aspekter af høj effektivitet afdækketTegningen illustrerer vekselvirkningen af den organiske methylammoniumkation (CH3NH3+) med de omgivende iodidioner. Skiftet af iodidatomerne ud af det fælles plan med bly forårsager brud på inversio -
 Video:Hvad er hvid chokolade?Kredit:The American Chemical Society I dag, vi viser vores kærlighed til hvid chokolade. Jo da, den mangler den rige smag af mælkechokolade og den blanke brune farve af mørk chokolade. Og mange m
Video:Hvad er hvid chokolade?Kredit:The American Chemical Society I dag, vi viser vores kærlighed til hvid chokolade. Jo da, den mangler den rige smag af mælkechokolade og den blanke brune farve af mørk chokolade. Og mange m -
 Eksperimentel undersøgelse af, hvordan metalglas former, udfordrer paradigme inden for glasforsknin…Metalliske briller som produceret i Lab på Saarland University. Kredit:Gallino/Busch Medmindre du tilfældigvis er en materialeforsker, hvilket de fleste af os trods alt ikke er, udtrykket briller
Eksperimentel undersøgelse af, hvordan metalglas former, udfordrer paradigme inden for glasforsknin…Metalliske briller som produceret i Lab på Saarland University. Kredit:Gallino/Busch Medmindre du tilfældigvis er en materialeforsker, hvilket de fleste af os trods alt ikke er, udtrykket briller
- Mineral, der er højere koncentrationer i hårdt vand end blødt vand?
- Område, hvor laboratorietermometer viser den samme temperatur på Celsius og Fahrenheit?
- Hvordan QR-koder fungerer, og hvad gør dem farlige:En datalog forklarer
- Sådan beregnes en Bell Curve
- Jaws:Hvordan en afrikansk strålefinnet fisk hjælper os med at genoverveje evolutionens grundlægge…
- Hvordan påvirker højden sammensætningen af skyer?


