En kemiker syntetiserer tinjodid i henhold til den kemiske reaktion vist nedenfor starterne med 15,0 g og overskydende jod efter 66,3 opnås Hvad er?
Forståelse af reaktionen:
Den reaktion, du beskriver, er syntesen af tin (II) iodid (SNI₂):
Sn + i₂ → Sni₂
Hvad vi ved:
* startmasse af tin (SN): 15,0 g
* overskydende jod (i₂): Dette betyder, at vi har nok jod til at sikre, at alle tin reagerer.
* faktisk udbytte af tin iodid (SNI₂): 66,3 g
hvad vi har brug for at finde:
* Procentudbytte: Dette er forholdet mellem det faktiske udbytte og det teoretiske udbytte, udtrykt som en procentdel.
trin til at løse:
1. Beregn det teoretiske udbytte:
* Konverter massen af tin til mol:15,0 g Sn / 118,71 g / mol Sn =0,126 mol SN
* Fra den afbalancerede ligning producerer 1 mol Sn 1 mol Sni₂. Derfor vil 0,126 mol SN producere 0,126 mol SNI₂.
* Konverter mol Sni₂ til gram:0,126 mol Sni₂ × 325,5 g/mol Sni₂ =41,0 g Sni₂ (teoretisk udbytte)
2. Beregn procentudbyttet:
* Procent udbytte =(faktisk udbytte / teoretisk udbytte) × 100%
* Procent udbytte =(66,3 g / 41,0 g) × 100% =161,7%
Svaret:
Procentudbyttet af reaktionen er 161,7% .
Vigtig note: En procentdel afgår over 100% er usædvanligt og antyder en potentiel fejl i eksperimentet. Det kan skyldes faktorer som:
* urenheder i produktet: Det faktiske udbytte kan omfatte urenheder, hvilket fører til en højere målt masse.
* Forkerte målinger: Fejl ved at veje reaktanterne eller produkterne kan påvirke udbytteberegningen.
* bivirkninger: Andre reaktioner kan forekomme, hvilket fører til yderligere produkter, der vejes som en del af det ønskede produkt.
Det er vigtigt at overveje disse muligheder, når man fortolker en procentdel afkastet over 100%.
 Varme artikler
Varme artikler
-
 At lære nye tricks fra havsvampe, naturens mest usandsynlige civilingeniørerGlasfibrene, der udgør Euplectella aspergillum-svampen, er overraskende stærke og fleksible. Kredit:Michael A Monn, CC BY-ND Forestil dig en fremtid, hvor bygninger knejser kilometervis over gader
At lære nye tricks fra havsvampe, naturens mest usandsynlige civilingeniørerGlasfibrene, der udgør Euplectella aspergillum-svampen, er overraskende stærke og fleksible. Kredit:Michael A Monn, CC BY-ND Forestil dig en fremtid, hvor bygninger knejser kilometervis over gader -
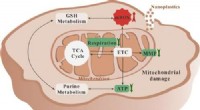 Nanoplast kan forstyrre menneskelige lever- og lungecelleprocesser i laboratorieeksperimenterGrafisk abstrakt. Kredit:Environmental Science &Technology (2022). DOI:10.1021/acs.est.2c03980 Hvad sker der, når folk ubevidst spiser, drikker eller inhalerer næsten usynlige plastikstykker? Selvo
Nanoplast kan forstyrre menneskelige lever- og lungecelleprocesser i laboratorieeksperimenterGrafisk abstrakt. Kredit:Environmental Science &Technology (2022). DOI:10.1021/acs.est.2c03980 Hvad sker der, når folk ubevidst spiser, drikker eller inhalerer næsten usynlige plastikstykker? Selvo -
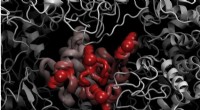 Elastisk inkohærent neutronspredning ved ILL udfordrer Lindemann-kriteriet i proteinerEt billede af lysozymproteinet, mens det smelter Proteiner er de nanomaskiner, som naturen bruger til at udføre de fleste af de processer, der er kritiske for metabolismen i celler. Et af hovedmål
Elastisk inkohærent neutronspredning ved ILL udfordrer Lindemann-kriteriet i proteinerEt billede af lysozymproteinet, mens det smelter Proteiner er de nanomaskiner, som naturen bruger til at udføre de fleste af de processer, der er kritiske for metabolismen i celler. Et af hovedmål -
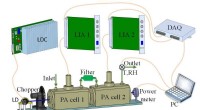 Ny sensor til måling af atmosfæriske aerosoler og nitrogendioxid samtidigtEksperimentel opsætning af D-PAS. Kredit:LIU Kun For nylig, Prof. 2 ) samtidigt. Atmosfæriske aerosoler og NO 2 betragtes som de vigtigste forurenende stoffer i luften, mens online måling af
Ny sensor til måling af atmosfæriske aerosoler og nitrogendioxid samtidigtEksperimentel opsætning af D-PAS. Kredit:LIU Kun For nylig, Prof. 2 ) samtidigt. Atmosfæriske aerosoler og NO 2 betragtes som de vigtigste forurenende stoffer i luften, mens online måling af
- Effektiv depolymerisering i fast tilstand af affald PET
- Er der en sag mod lykke?
- Hvordan påvirker tilføjelse og fjernelse af kraft et objekt i bevægelse og i hvile?
- Nanopartikler, pH-forese kunne forbedre kræfttilførselen
- Forskere udvikler rammer til modellering af infrastrukturens modstandsdygtighed efter jordskælv
- Hvad var Louis -bidrag om mikrobiologi?


