Kan vand opdeles mellem brint og ilt?
Sådan fungerer det:
* elektrolyse: En elektrisk strøm ledes gennem vand. Vandmolekylerne er opdelt i deres bestanddele, brint og ilt.
* Elektroder: To elektroder anbringes i vandet. Den ene elektrode er positivt ladet (anode), og den anden er negativt ladet (katode).
* reaktion: Ved katoden får vandmolekyler elektroner og reduceres til brintgas (H2). Ved anoden mister vandmolekyler elektroner og oxideres til iltgas (O2).
Kemisk ligning:
2H₂O (L) → 2H₂ (G) + O₂ (G)
Vigtige noter:
* Elektrolyse kræver en jævnstrøm (DC) kilde.
* Processen udføres typisk i en elektrolytisk celle indeholdende en elektrolyt, såsom natriumhydroxid eller kaliumhydroxid, for at forbedre ledningsevnen.
* Forholdet mellem brint og produceret ilt er altid 2:1.
Anvendelser af vandelektrolyse:
* brintproduktion: Elektrolyse er en nøglemetode til produktion af brint, der kan bruges som et rent brændstof.
* Oxygenproduktion: Elektrolyse kan også producere ilt, som har forskellige industrielle anvendelser.
* Vandoprensning: Elektrolyse kan bruges til at fjerne urenheder fra vand.
Konklusion:
Vand kan opdeles i brint og ilt gennem elektrolyseprocessen. Dette er en afgørende proces i forskellige anvendelser, herunder brintproduktion, iltproduktion og vandrensning.
Sidste artikelHvorfor kommer naturgas til at overflade alene?
Næste artikelHvor mange mol i 114 g SBCL3?
 Varme artikler
Varme artikler
-
 Solbrint:Bedre fotoelektroder gennem flashopvarmningPulserende laseraflejring:En intens laserimpuls rammer et mål, der indeholder materialet, og transformerer det til et plasma, som derefter afsættes som en tynd film på et substrat. Kredit:R. Gottesman
Solbrint:Bedre fotoelektroder gennem flashopvarmningPulserende laseraflejring:En intens laserimpuls rammer et mål, der indeholder materialet, og transformerer det til et plasma, som derefter afsættes som en tynd film på et substrat. Kredit:R. Gottesman -
 Gennembrud skaber hårdt materiale, der kan strække sig, helbrede og forsvare sig selvEn specialitet i den kinesiske by Xian er håndstrakte nudler - hvis struktur inspirerede to forskere fra University of Chicago til at skabe et bedre syntetisk væv. Kredit:Shutterstock Mens man spi
Gennembrud skaber hårdt materiale, der kan strække sig, helbrede og forsvare sig selvEn specialitet i den kinesiske by Xian er håndstrakte nudler - hvis struktur inspirerede to forskere fra University of Chicago til at skabe et bedre syntetisk væv. Kredit:Shutterstock Mens man spi -
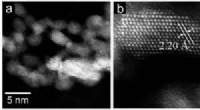 En rutheniumbaseret katalysator med højaktiv, flade overflader overgår metalbaserede konkurrenterAnalyse ved hjælp af højvinklet ringformet mørkfelt-scanningstransmissionselektronmikroskopi (HAADF-STEM) afslørede:(a) små og flade ruthenium-pletter over et stort domæne og (b) gitterafstanden svare
En rutheniumbaseret katalysator med højaktiv, flade overflader overgår metalbaserede konkurrenterAnalyse ved hjælp af højvinklet ringformet mørkfelt-scanningstransmissionselektronmikroskopi (HAADF-STEM) afslørede:(a) små og flade ruthenium-pletter over et stort domæne og (b) gitterafstanden svare -
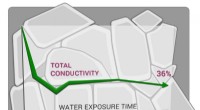 Forskere viser, at en lovende fast elektrolyt er hydrofobSkoltech-forskere og deres kolleger har vist, at LATP, en fast elektrolyt, der overvejes til brug i næste generations energilagring, er meget følsom over for vand, hvilket har direkte konsekvenser for
Forskere viser, at en lovende fast elektrolyt er hydrofobSkoltech-forskere og deres kolleger har vist, at LATP, en fast elektrolyt, der overvejes til brug i næste generations energilagring, er meget følsom over for vand, hvilket har direkte konsekvenser for
- Støv som partikler af pulveriseret sten sprængt i luften?
- Afbrød Brexit-afstemningen kvinder politisk?
- Hvorfor opstår konvektion i et fast materiale?
- Skal du tilføje klor til dit vand?
- Hvor er mitokondrier hos mand?
- Hvilke faktorer er vigtige for at vurdere, hvor nyttig en energiressource er for os?


