Hvad er den korrekte reaktionsvarme for sammensætning To mol vand?
Her er en sammenbrud af, hvad vi kan forstå:
* Dannelse af vand: Standardreaktionen til dannelse af vand er:
`` `
2H₂ (G) + O₂ (G) → 2H₂O (L)
`` `
* reaktionsvarme (entalpiændring): Reaktionsvarmen, også kendt som entalpiændring (ΔH), fortæller os, hvor meget varme frigøres eller absorberes under en reaktion. Til dannelse af vand er standard enthalpiændring (ΔH °) -571,6 kJ/mol . Dette betyder, at 571,6 kJ varme frigøres, når to mol vand dannes fra deres elementer i deres standardtilstande.
Derfor er den korrekte reaktionsvarme til dannelse af to mol vand -571,6 kJ.
Bemærk: Det negative tegn indikerer, at reaktionen er eksoterm, hvilket betyder, at varme frigøres.
 Varme artikler
Varme artikler
-
 Hydrogel-komposit udviklet til at hjælpe beskyttelsesudstyr med hurtigt at nedbryde giftige nervest…Kredit:Pixabay/CC0 Public Domain Forskere ved Northwestern University i Evanston, Illinois har udviklet en hydrogel integreret med zirconium-baserede robuste metal-organiske rammer (MOFer), der hu
Hydrogel-komposit udviklet til at hjælpe beskyttelsesudstyr med hurtigt at nedbryde giftige nervest…Kredit:Pixabay/CC0 Public Domain Forskere ved Northwestern University i Evanston, Illinois har udviklet en hydrogel integreret med zirconium-baserede robuste metal-organiske rammer (MOFer), der hu -
 Alger som levende biokatalysatorer for en grøn industriKredit:CC0 Public Domain Mange stoffer, som vi bruger hver dag, virker kun i den rigtige 3-D struktur. Naturlige enzymer kunne producere disse på en miljøvenlig måde - hvis de ikke havde brug for
Alger som levende biokatalysatorer for en grøn industriKredit:CC0 Public Domain Mange stoffer, som vi bruger hver dag, virker kun i den rigtige 3-D struktur. Naturlige enzymer kunne producere disse på en miljøvenlig måde - hvis de ikke havde brug for -
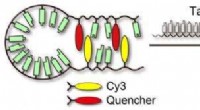 Cyaninfarvestoffer kunne forbedre effektiviteten af molekylære proberRNA-detektionsskema:Det hårnåleformede molekyle åbner sig hurtigt, kombineres med dets komplementære mål og fluorescerer klart. Kredit:Videnskab og teknologi for avancerede materialer Forskere bru
Cyaninfarvestoffer kunne forbedre effektiviteten af molekylære proberRNA-detektionsskema:Det hårnåleformede molekyle åbner sig hurtigt, kombineres med dets komplementære mål og fluorescerer klart. Kredit:Videnskab og teknologi for avancerede materialer Forskere bru -
 Synligt lys og nanopartikelkatalysatorer producerer ønskelige bioaktive molekylerMolekyler adsorberer på overfladen af halvledernanopartikler i meget specifikke geometrier. Nanopartiklerne bruger energi fra indfaldende lys til at aktivere molekylerne og smelte dem sammen til at
Synligt lys og nanopartikelkatalysatorer producerer ønskelige bioaktive molekylerMolekyler adsorberer på overfladen af halvledernanopartikler i meget specifikke geometrier. Nanopartiklerne bruger energi fra indfaldende lys til at aktivere molekylerne og smelte dem sammen til at
- Måling af kræfter fra levende celler og mikroorganismer
- Ville en ballon fyldt med vakuum i stedet for helium flyde?
- Hvor stor er Venus sammenlignet med planeterne?
- Forbindelse med fortiden:AI for at finde og bevare Europas historiske dufte
- Ny NASA-laserteknologi afslører, hvordan is måler sig
- Billede:Hubbles kosmiske feriekrans


