Hvordan navngiver du en forbindelse, når elementerne er i den samme kolonne periodiske tabel?
Her er en sammenbrud:
1. Identificer elementerne:
* Bestem hvilket element der er mere elektronegativt. Elektronegativitet øges generelt, når du bevæger dig op og til højre på den periodiske tabel.
* Det mere elektronegative element vil blive navngivet nummer to i forbindelsens navn (som anionen).
2. Navngiv kationerne:
* Metaller: De fleste metaller har en fast ladning, så deres navn forbliver uændret (f.eks. Natrium, kalium).
* ikke -metaller: Ikke -metaller kan danne flere anioner. Brug romertal til at indikere ladningen af kationen i parenteser efter elementets navn (f.eks. Fosfor (III), klor (V)).
3. Navngiv anionerne:
* Tilføj suffikset "-ide" til rodnavnet på ikke-metalen (f.eks. Chlorid, sulfid, oxid).
* Ikke -metaller kan have flere anioner. Brug præfikser som "hypo-" (mindre ilt), "-ite" (færre ilt), "-at" (mere ilt) og "per-" (mest ilt) for at indikere det relative antal iltatomer.
Eksempler:
* ilt og svovl: Oxygen er mere elektronegativ.
* ilt (O) + svovl (er) → Svovloxid (SO)
* ilt (O) + svovl (er) → Svovldioxid (SO2)
* ilt (O) + svovl (r) → Svovltrioxid (SO3)
* nitrogen og fosfor: Fosfor er mere elektronegativ.
* nitrogen (N) + fosfor (P) → Nitrogenphosphid (NP)
* kalium og natrium: Begge er metaller.
* kalium (K) + natrium (NA) → kaliumnatrium (KNA) (Dette er en intermetallisk forbindelse)
Nøglepunkter:
* præfikser: Brug præfikser som "di-", "tri-", "tetra-" osv., For at indikere antallet af atomer i hvert element i forbindelsen.
* Gebyrer: Sørg for, at afgifterne er balance for den samlede forbindelse.
* Intermetalliske forbindelser: Forbindelser mellem to metaller kaldes normalt "intermetalliske forbindelser" og kaldes blot ved at angive metaller i rækkefølge af stigende elektronegativitet.
Husk: Den kemiske formel for forbindelsen dikterer altid det nøjagtige navn. Disse regler giver en retningslinje for navngivning af forbindelser, men det er vigtigt at forstå de specifikke egenskaber for hvert involveret element.
 Varme artikler
Varme artikler
-
 Kuldioxidreduktion på Jorden og magnesiumcivilisation på MarsBoble luften i vand med en knivspids magnesium, og vi får brændstof. Kredit:Vivek Polshettiwar Overdreven CO 2 emissioner er en væsentlig årsag til klimaændringer, og dermed reducere CO 2 nive
Kuldioxidreduktion på Jorden og magnesiumcivilisation på MarsBoble luften i vand med en knivspids magnesium, og vi får brændstof. Kredit:Vivek Polshettiwar Overdreven CO 2 emissioner er en væsentlig årsag til klimaændringer, og dermed reducere CO 2 nive -
 Video:Sådan får kimchi sit kickKredit:The American Chemical Society Kimchi, den fermenterede kålskål, der er elsket i Korea og rundt om i verden, har en signatur skarp, sur tang. Disse unikke smag kommer fra ikke kun salt og k
Video:Sådan får kimchi sit kickKredit:The American Chemical Society Kimchi, den fermenterede kålskål, der er elsket i Korea og rundt om i verden, har en signatur skarp, sur tang. Disse unikke smag kommer fra ikke kun salt og k -
 Forskere afslører in situ manipulation af aktivt guld-titandioxid-interfaceGeometrisk og elektronisk struktur af Au-TiO 2 grænseflade under CO/O 2 (EN, C, E) og O 2 miljø (B, D, F). Kredit:GAO Yi Et internationalt fælles forskerhold fra Shanghai Advanced Research I
Forskere afslører in situ manipulation af aktivt guld-titandioxid-interfaceGeometrisk og elektronisk struktur af Au-TiO 2 grænseflade under CO/O 2 (EN, C, E) og O 2 miljø (B, D, F). Kredit:GAO Yi Et internationalt fælles forskerhold fra Shanghai Advanced Research I -
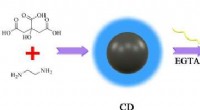 Kulstofprikker gør calcium lettere at sporeIllustration af Ca2+ -detektering ved hjælp af EGTA-modificerede cder. Kredit:SIBET På hospitaler, læger råder ofte patienter til at tage calciumtilskud. Men kommer calcium ind i de celler, der ha
Kulstofprikker gør calcium lettere at sporeIllustration af Ca2+ -detektering ved hjælp af EGTA-modificerede cder. Kredit:SIBET På hospitaler, læger råder ofte patienter til at tage calciumtilskud. Men kommer calcium ind i de celler, der ha
- Eksperimenter i isolation:Træning af astronauter til langsigtede solomissioner
- Hvad betyder, at de emmererer grene af det?
- Hvorfor er kulilte er svært at opdage?
- Forfærdet over olieudslip, nogle i Huntington Beach siger, at det er tid til at afslutte offshore b…
- Hvilken slags fordøjelsessystem har squids?
- Nyt nanopartikel-lægemiddelleveringssystem forbedrer behandling af åreforkalkning


