Hvilken slags støkiometri -problem er, hvor mange kubikcentimeter kuldioxidgas produceres ved opvarmning af 0,750 gram bagepulver?
Her er hvorfor:
* Masse-til-volumen: Problemet giver dig massen af en reaktant (bagepulver) og beder om volumen af et produkt (kuldioxidgas).
* støkiometri: Problemet kræver, at du bruger den afbalancerede kemiske ligning til reaktionen for at relatere mængden af reaktanter og produkter.
Lad os nedbryde det yderligere:
1. Kemisk ligning: Reaktionen af bagepulver (natriumbicarbonat, nahco₃), når den opvarmes, er:
2 Nahco₃ (S) → Na₂co₃ (S) + H₂O (G) + CO₂ (G)
2. støkiometri: Ligningen viser, at 2 mol Nahco₃ producerer 1 mol co₂.
3. Masse-til-mol: Du skal konvertere den givne masse af Nahco₃ til mol ved hjælp af dens molære masse.
4. mol-til-mol: Brug molforholdet fra den afbalancerede ligning til at finde antallet af mol produceret co₂.
5. mol-til-volumen: Hvis du antager, at kuldioxidgas opfører sig ideelt, kan du bruge den ideelle gaslov (PV =NRT) til at omdanne mol CO₂ til volumen ved en given temperatur og tryk (som normalt antages at være standardbetingelser).
For at løse dette problem skal du derfor udføre disse trin:
1. Konverter gram af Nahco₃ til mol.
2. Brug molforholdet fra den afbalancerede ligning til at finde mol co₂.
3. Brug den ideelle gaslov (PV =NRT) til at beregne mængden af CO₂ ved en given temperatur og tryk.
Sidste artikelHvad er Lewis -strukturer i CH2?
Næste artikelHvilken gas fungerer som den endelige acceptor af elektroner i?
 Varme artikler
Varme artikler
-
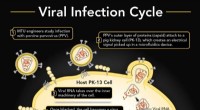 Microfluidics hjælper ingeniører med at se virusinfektion i realtid1. Porcint parvovirus (PPV) inficerer en svinenyrecelle (PK-13). 2. PPV binder sig til PK-13 ved hjælp af dets ydre lag af proteiner (kapsid), som kan detekteres i en mikrofluidikanordning. 3. Det vir
Microfluidics hjælper ingeniører med at se virusinfektion i realtid1. Porcint parvovirus (PPV) inficerer en svinenyrecelle (PK-13). 2. PPV binder sig til PK-13 ved hjælp af dets ydre lag af proteiner (kapsid), som kan detekteres i en mikrofluidikanordning. 3. Det vir -
 Ikke-invasiv mikroskopi detekterer aktiveringstilstand og skelner mellem celletyperMetoder til at udtrække funktioner fra mærkefri immuncelleanalyse. Multivariat etiketfri data, sammensat af både morfologiske og spektrale parametre, bruges til at identificere funktioner på højt nive
Ikke-invasiv mikroskopi detekterer aktiveringstilstand og skelner mellem celletyperMetoder til at udtrække funktioner fra mærkefri immuncelleanalyse. Multivariat etiketfri data, sammensat af både morfologiske og spektrale parametre, bruges til at identificere funktioner på højt nive -
 Skinnende røntgenlys på perovskiter for bedre solcellerKredit:CC0 Public Domain Opkaldt efter et mineral opdaget i Uralbjergene i Rusland, perovskites har taget i centrum som en klasse af materialer med egenskaber, der kan anvendes på fremtidige elekt
Skinnende røntgenlys på perovskiter for bedre solcellerKredit:CC0 Public Domain Opkaldt efter et mineral opdaget i Uralbjergene i Rusland, perovskites har taget i centrum som en klasse af materialer med egenskaber, der kan anvendes på fremtidige elekt -
 Gør havvand drikkeligt på få minutterSkematisk oversigt over koaksial elektrospinning. Kredit:Elsevier Ifølge Verdenssundhedsorganisationen omkring 785 millioner mennesker rundt om i verden mangler en ren drikkevandskilde. På trods a
Gør havvand drikkeligt på få minutterSkematisk oversigt over koaksial elektrospinning. Kredit:Elsevier Ifølge Verdenssundhedsorganisationen omkring 785 millioner mennesker rundt om i verden mangler en ren drikkevandskilde. På trods a
- Satellitter viser vejen til nye oliefund
- Moderne økonomisk teori forklarer forhistoriske middelhavssamfund
- Hvad er temperaturen 89.2degrees Celsius i Fahrenheit?
- Ultratynde prøver med overfladefononpolariton forbedrer fotoinduceret dipolkraft
- Forskere arbejder hen imod systematisk vurdering af klimamodeller
- Hvorfor skal jeg ikke svømme lige efter jeg har spist?


