Hvad er Lewis -strukturer i CH2?
* carbon ønsker fire obligationer: Carbon har fire valenselektroner og ønsker at danne fire bindinger for at opnå en stabil oktet.
* brint ønsker en binding: Hydrogen har en valenselektron og ønsker at danne en binding for at opnå en stabil duet.
Problemet:
* I CH₂ ville kulstof kun have to obligationer. Det ville have to uparrede elektroner, hvilket gør molekylet meget reaktivt og ustabilt.
mulige løsninger:
* methylen (ch₂): CH₂ er en meget reaktiv mellemprodukt kaldet methylen. Det har to uparrede elektroner på carbonatomet. Det findes kun i meget kort tid og er ikke et stabilt molekyle.
* Større molekyler: Ch₂ kan være en komponent i større molekyler som:
* alkanes: CH₂ -enheder kan danne en lang kæde (som i polyethylen).
* alkenes: Ch₂ kan være en del af en dobbeltbinding (som i ethen).
Lad os overveje et eksempel:
* ethylen (c₂h₄): Formlen er c₂h₄. Dette har to carbonatomer, der hver er bundet til to hydrogenatomer og en dobbeltbinding mellem kulhydraterne. Dette tilfredsstiller limningskravene for både kulstof og brint.
Fortæl mig, hvis du gerne vil udforske Lewis -strukturer af molekyler som ethen eller andre stabile forbindelser, der indeholder kulstof og brint!
 Varme artikler
Varme artikler
-
 Ny metode udviklet til at udvinde antibiotikarester i fødevarer fra animalske kilderDen forsker, der er ansvarlig for undersøgelsen, Soledad González, i laboratoriet Kredit:University of Córdoba Coccidiose er en slags tarmsygdom, der rammer forskellige grupper af dyr. Det hæmmer
Ny metode udviklet til at udvinde antibiotikarester i fødevarer fra animalske kilderDen forsker, der er ansvarlig for undersøgelsen, Soledad González, i laboratoriet Kredit:University of Córdoba Coccidiose er en slags tarmsygdom, der rammer forskellige grupper af dyr. Det hæmmer -
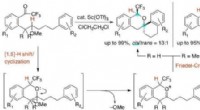 Ny syntese af komplekse organiske molekyler afsløretVi udviklede en effektiv metode til diastereoselektiv syntese af CF3-substituerede spiroisochromaner via C(sp3)¬-H-bindingsfunktionalisering, der involverer sekventielle transformationer ([1, 5] -hydr
Ny syntese af komplekse organiske molekyler afsløretVi udviklede en effektiv metode til diastereoselektiv syntese af CF3-substituerede spiroisochromaner via C(sp3)¬-H-bindingsfunktionalisering, der involverer sekventielle transformationer ([1, 5] -hydr -
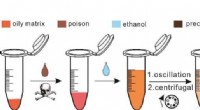 Ethanol-ekstraktion SERS-strategi giver meget følsom påvisning af giftstoffer i olieagtig matrixSkematisk diagram af SERS-detektion baseret på ethanolekstraktion. Kredit:WANG Yongtao Forskere fra det kinesiske videnskabsakademi (CAS) udviklede for nylig en ethanol-ekstraktionsoverfladeforstæ
Ethanol-ekstraktion SERS-strategi giver meget følsom påvisning af giftstoffer i olieagtig matrixSkematisk diagram af SERS-detektion baseret på ethanolekstraktion. Kredit:WANG Yongtao Forskere fra det kinesiske videnskabsakademi (CAS) udviklede for nylig en ethanol-ekstraktionsoverfladeforstæ -
 Mikrobølger mod koldstart-emissionerDen geometriske keramiske struktur af testkatalysatoren designet på computeren. Specialister hos Empa coated det med det katalytisk aktive lag og testede renseeffekten i en kunstig strøm af udstødning
Mikrobølger mod koldstart-emissionerDen geometriske keramiske struktur af testkatalysatoren designet på computeren. Specialister hos Empa coated det med det katalytisk aktive lag og testede renseeffekten i en kunstig strøm af udstødning
- Hvad er de vigtige jordalkalimetaller i menneskekroppen?
- Fleksibel dielektrisk polymer kan tåle varmen
- Forskere finder en stigning på 70 procent i atmosfærisk brint i løbet af de sidste 150 år
- Hvad lærte Mariner 10 og Messenger os om Merkur?
- At identificere et falsk billede online er sværere, end du måske tror
- Hvordan simuleringer kunne hjælpe med at få PFAS ud af jorden


