Hvorfor får opvarmning af et stof, det reagerer hurtigere?
1. Øget kinetisk energi:
* Varme giver energi til molekylerne af et stof. Denne energi får molekylerne til at bevæge sig hurtigere og vibrere mere intenst.
* Denne øgede kinetiske energi fører til hyppigere kollisioner mellem molekyler.
2. Mere effektive kollisioner:
* Ved højere temperaturer kolliderer molekyler med mere energi.
* Denne øgede energi gør kollisionerne mere effektive, hvilket betyder, at de er mere tilbøjelige til at bryde eksisterende bindinger og danne nye, hvilket fører til en reaktion.
3. Overvinde aktiveringsenergi:
* For at der forekommer en reaktion, skal molekyler overvinde en bestemt energibarriere kaldet aktiveringsenergi.
* Varme giver den nødvendige energi til at overvinde denne barriere. Flere molekyler har nok energi til at reagere ved højere temperaturer.
4. Øget antal molekyler med tilstrækkelig energi:
* Fordelingen af molekylære energier følger en Boltzmann -distribution. Når temperaturen stiger, skifter toppen af distributionen mod højere energier.
* Dette betyder, at ved højere temperaturer har en større andel af molekyler den minimale energi, der kræves for at reagere.
5. Ændringer i reaktionsmekanismen:
* I nogle tilfælde kan opvarmning ændre reaktionsmekanismen selv, hvilket fører til en hurtigere reaktionshastighed.
Kortfattet:
Opvarmning af et stof øger molekylernes kinetiske energi, hvilket fører til hyppigere og effektive kollisioner. Dette øger igen antallet af molekyler med tilstrækkelig energi til at overvinde aktiveringsenergibarriere, hvilket resulterer i en hurtigere reaktionshastighed.
 Varme artikler
Varme artikler
-
 Avancerede biomaterialer med silkefibroin-bioaktivt glas til at konstruere patientspecifikke 3D-knog…Udvikling af avancerede hybride biomaterialer ved hjælp af tilpasset 3D-printsoftware. Kredit:RoboCAD, 3D blæk, LLC, doi:10.1088/1748-605X/aad2a9 Den komplekse arkitektur af knogler er udfordrende
Avancerede biomaterialer med silkefibroin-bioaktivt glas til at konstruere patientspecifikke 3D-knog…Udvikling af avancerede hybride biomaterialer ved hjælp af tilpasset 3D-printsoftware. Kredit:RoboCAD, 3D blæk, LLC, doi:10.1088/1748-605X/aad2a9 Den komplekse arkitektur af knogler er udfordrende -
 Forskere opdager ny transportrute for flygtige planteforbindelserEn petuniaknop, der ikke har åbnet sig (øverst), vil fra luften overføre flygtige forbindelser fra blomstens rør til stigmaet før åbning. Opdagelsen, af Purdue University videnskabsmænd, er den første
Forskere opdager ny transportrute for flygtige planteforbindelserEn petuniaknop, der ikke har åbnet sig (øverst), vil fra luften overføre flygtige forbindelser fra blomstens rør til stigmaet før åbning. Opdagelsen, af Purdue University videnskabsmænd, er den første -
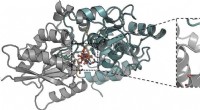 Sultende tuberkulose af sukkerarter kan være en ny måde at bekæmpe det påDetaljer på molekylært niveau af interaktionen af trehalose bundet til den mykobakterielle LpqY-transporter. Kredit:University of Warwick Tuberkulose er en ødelæggende sygdom, der kræver over 1,
Sultende tuberkulose af sukkerarter kan være en ny måde at bekæmpe det påDetaljer på molekylært niveau af interaktionen af trehalose bundet til den mykobakterielle LpqY-transporter. Kredit:University of Warwick Tuberkulose er en ødelæggende sygdom, der kræver over 1, -
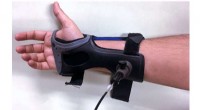 Forskere viser effektiviteten af en ny ikke -invasiv blodglukosetestRamanspektroskopi blodglukosemonitor. Kredit:Massachusetts Institute of Technology For dem, der lever med diabetes, nøjagtig overvågning af blodglukose er nødvendig for at forhindre diabetesrelate
Forskere viser effektiviteten af en ny ikke -invasiv blodglukosetestRamanspektroskopi blodglukosemonitor. Kredit:Massachusetts Institute of Technology For dem, der lever med diabetes, nøjagtig overvågning af blodglukose er nødvendig for at forhindre diabetesrelate
- Samtidige klimahændelser risikerer at skade hele socioøkonomiske systemer
- Hvad får en hastighed til at ændre sig?
- Den type livscyklus, der ses i planter, kaldes?
- Ud over Uber-bølgen:Sådan kommer du rundt nytårsaften
- Manden, der kæmpede mod flammerne for at redde sit hjørne af Paradiset
- Hvad er fordele eller ulemper ved at bruge det metriske system?


