Hvor mange atomer af O2 er der i en 1,76sample CO2?
1. Bestem den molære masse af CO2
* Carbon (C) har en molmasse på 12,01 g/mol
* Oxygen (O) har en molmasse på 16,00 g/mol
* Molmasse CO2 =12,01 g/mol + (2 * 16,00 g/mol) =44,01 g/mol
2. Beregn molen af CO2
* Vi får en 1,76 g prøve af CO2.
* Mol CO2 =(masse af CO2) / (molmasse CO2)
* Mol CO2 =1,76 g / 44,01 g / mol =0,04 mol
3. Bestem molen af O2
* Den kemiske formel CO2 fortæller os, at der er 2 mol iltatomer for hver 1 mol CO2.
* Mol O -atomer =0,04 mol CO2 * (2 mol O atomer / 1 mol CO2) =0,08 mol O atomer
4. Beregn antallet af O2 -molekyler
* Avogadros nummer fortæller os, at der er 6,022 x 10^23 molekyler i en mol af ethvert stof.
* Antal O2 -molekyler =(mol af O -atomer) * (Avogadro's nummer)
* Antal O2 -molekyler =0,08 mol * (6,022 x 10^23 molekyler/mol) =4,82 x 10^22 molekyler
Derfor er der ca. 4,82 x 10^22 O2 -molekyler i en 1,76 g prøve af CO2.
 Varme artikler
Varme artikler
-
 Bare tilsæt vand - Kemikere afslører en mekanisme bag doping af organiske halvledereDenne Lewis-syre ændrer de elektriske egenskaber af visse organiske halvledere, når den tilsættes i tilstedeværelsen af vand Kredit: Brett Yurash Halvledere – og vores beherskelse af dem – har g
Bare tilsæt vand - Kemikere afslører en mekanisme bag doping af organiske halvledereDenne Lewis-syre ændrer de elektriske egenskaber af visse organiske halvledere, når den tilsættes i tilstedeværelsen af vand Kredit: Brett Yurash Halvledere – og vores beherskelse af dem – har g -
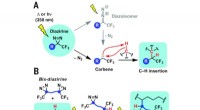 En ny form for lim til at binde polyethylenEn bis-diazirin-strategi til polymertværbinding. (A) Mekanisme for carbendannelse fra lys- eller varmefremkaldt nedbrydning af diaziriner, efterfulgt af C – H indsættelse. hν, ultraviolet lys. (B) Tvæ
En ny form for lim til at binde polyethylenEn bis-diazirin-strategi til polymertværbinding. (A) Mekanisme for carbendannelse fra lys- eller varmefremkaldt nedbrydning af diaziriner, efterfulgt af C – H indsættelse. hν, ultraviolet lys. (B) Tvæ -
 Udvikling af et værktøj til strømlinet molekylvægtsanalyseKredit:Unsplash/CC0 Public Domain Ny verdensførste forskning ledet af Griffith University har strømlinet processen med at identificere strukturen og molekylvægten af forbindelser, som kunne have
Udvikling af et værktøj til strømlinet molekylvægtsanalyseKredit:Unsplash/CC0 Public Domain Ny verdensførste forskning ledet af Griffith University har strømlinet processen med at identificere strukturen og molekylvægten af forbindelser, som kunne have -
 Wafer-skala flerlags fremstilling af silke fibroin-baseret mikroelektronikFigur 1. Forsiden af ACS anvendte materialer og grænseflader . Kredit: ACS anvendte materialer og grænseflader Et KAIST-forskerhold udviklede en ny fremstillingsmetode til flerlagsbehandling af
Wafer-skala flerlags fremstilling af silke fibroin-baseret mikroelektronikFigur 1. Forsiden af ACS anvendte materialer og grænseflader . Kredit: ACS anvendte materialer og grænseflader Et KAIST-forskerhold udviklede en ny fremstillingsmetode til flerlagsbehandling af
- FORKLARER:Hvordan Ida kan være så dødelig 1000 miles fra landgang
- Hvad er delene af en hvirveldyr?
- Udnyttelse af videnskabsmænds opfattelser til vellykket interaktion med politiske beslutningstagere
- Hvor mange milliliter er 115 milligram?
- Hvilke forbindelser dannes, når et lys brænder?
- Kan genteknologi redde forsvindende skove?


