Hvor mange valenselektroner har lithium (Li) til rådighed til binding?
Her er hvorfor:
* Elektronkonfiguration: Lithium har en elektronkonfiguration på 1S²2S¹.
* Valence Shell: Den yderste skal (2S -skallen) indeholder kun en elektron.
* binding: Atomer har en tendens til at vinde, miste eller dele elektroner for at opnå en stabil, fuld ydre skal (som ædelgasser). Lithium mister let sin enkelt valenselektron for at danne en +1 -ion og opnå en stabil elektronkonfiguration som helium (1S²).
Sidste artikelHvorfor glukose ikke er opløselig i benzin, men vand?
Næste artikelHvor mange atomer af O2 er der i en 1,76sample CO2?
 Varme artikler
Varme artikler
-
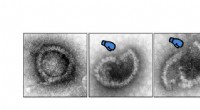 Et skridt på vejen mod bedre behandlinger mod viraEt elektronmikroskopbillede. Det viser, hvordan herpesvirus angribes af proteinet MxB. Kredit:Manutea Serrero &Beate Sodeik, Virology, Hannover Medical School, Tyskland. De fleste celler kan forsva
Et skridt på vejen mod bedre behandlinger mod viraEt elektronmikroskopbillede. Det viser, hvordan herpesvirus angribes af proteinet MxB. Kredit:Manutea Serrero &Beate Sodeik, Virology, Hannover Medical School, Tyskland. De fleste celler kan forsva -
 Ny teknik baner vejen for perfekte perovskitterEn ny teknik ved Advanced Light Source afslører, hvad der sker (fra venstre mod højre) i den anden før, i løbet af, og efter et fald af et størkningsmiddel omdanner en flydende forløberopløsning til e
Ny teknik baner vejen for perfekte perovskitterEn ny teknik ved Advanced Light Source afslører, hvad der sker (fra venstre mod højre) i den anden før, i løbet af, og efter et fald af et størkningsmiddel omdanner en flydende forløberopløsning til e -
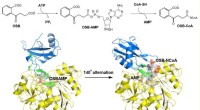 Forskere afslører tydelig substratbindende tilstand i o-succinylbenzoyl-CoA-syntetaseMenE katalyserer en totrinsreaktion i to forskellige strukturer. Kredit:Institut for Kemi, HKUST o-Succinylbenzoyl-CoA (OSB-CoA) syntetase (MenE) er et essentielt enzym i bakteriel vitamin K-biosy
Forskere afslører tydelig substratbindende tilstand i o-succinylbenzoyl-CoA-syntetaseMenE katalyserer en totrinsreaktion i to forskellige strukturer. Kredit:Institut for Kemi, HKUST o-Succinylbenzoyl-CoA (OSB-CoA) syntetase (MenE) er et essentielt enzym i bakteriel vitamin K-biosy -
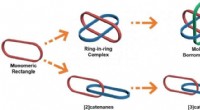 Alt-i-én-strategi for metalla[3]catenaner, Borromæiske ringe og ring-i-ring kompleksForskellige sammenlåste strukturer:monomert rektangel; ring-i-ring kompleks; Borromæiske ringe; [2]catenaner; lineære [3]catenaner. Kredit:Science China Press Sammenlåste molekylære arter har fået
Alt-i-én-strategi for metalla[3]catenaner, Borromæiske ringe og ring-i-ring kompleksForskellige sammenlåste strukturer:monomert rektangel; ring-i-ring kompleks; Borromæiske ringe; [2]catenaner; lineære [3]catenaner. Kredit:Science China Press Sammenlåste molekylære arter har fået
- Sådan finder du afstanden fra et punkt til en linje
- Hvordan detailhandlere kan ændre kundeadfærd for at fremme mere bæredygtige afkast
- Byer og lokalsamfund i USA mister 36 millioner træer om året
- Sådan bruges lakmuspapirer
- Har alle planeter en dag, der er 24 timer lang og år 365 dage?
- USA advarer om kraftig regn, tornadoer fra den svækkende storm Barry


