Hvorfor glukose ikke er opløselig i benzin, men vand?
glukose:
* polært molekyle: Glukose har mange hydroxyl (-OH) -grupper, hvilket gør det til et polært molekyle. Dette betyder, at det har en lidt positiv ende og en lidt negativ ende på grund af ujævn elektronfordeling.
* Hydrogenbinding: Hydroxylgrupperne i glukose kan danne hydrogenbindinger med vandmolekyler, som også er polære. Hydrogenbindinger er stærke attraktive kræfter mellem molekyler.
benzin (benzin):
* ikke-polært molekyle: Benzin er sammensat af kulbrinter, som er ikke-polære molekyler. Dette betyder, at de har en jævn fordeling af elektroner uden nogen signifikante positive eller negative mål.
* svage intermolekylære kræfter: Kulbrinter i benzin interagerer primært gennem svage van der Waals -kræfter, som er meget svagere end brintbindinger.
opløselighed:
* som opløser som: Princippet om "som opløser som" angiver, at polære stoffer opløses i polære opløsningsmidler, og ikke-polære stoffer opløses i ikke-polære opløsningsmidler.
* Vand: Da glukose er polær og vand er polær, kan de interagere gennem stærke brintbindinger, hvilket fører til glukoseopløsning i vand.
* benzin: Glukose kan ikke danne stærke interaktioner med de ikke-polære kulbrinter i benzin. De svage van der Waals -kræfter er utilstrækkelige til at overvinde den stærke hydrogenbinding inden for glukosemolekyler selv.
Kortfattet: Glukoses polaritet og evne til at danne brintbindinger med vand gør det opløseligt i vand, men ikke i benzin. Benzin, der er ikke-polær, kan ikke danne stærke interaktioner med det polære glukosemolekyle.
 Varme artikler
Varme artikler
-
 Isolerende mursten med mikroskopiske boblerFor at opnå de samme isoleringsværdier som en 165 mm tyk væg af aerobricks, en mur af perlitsten skal være 263 mm tyk — og en mur af ikke-isolerende mursten skal være mere end en meter. Kredit:Empa
Isolerende mursten med mikroskopiske boblerFor at opnå de samme isoleringsværdier som en 165 mm tyk væg af aerobricks, en mur af perlitsten skal være 263 mm tyk — og en mur af ikke-isolerende mursten skal være mere end en meter. Kredit:Empa -
 Elektronmikroskopi giver et nyt syn på lille virus med terapeutisk potentialeElektronmikroskopi giver et nyt syn på lille virus med terapeutisk potentiale. Indsat viser den cryo-EM-afledte struktur af en AAV2. Det fulde billede viser den eksperimentelt bestemte tæthed (grå) og
Elektronmikroskopi giver et nyt syn på lille virus med terapeutisk potentialeElektronmikroskopi giver et nyt syn på lille virus med terapeutisk potentiale. Indsat viser den cryo-EM-afledte struktur af en AAV2. Det fulde billede viser den eksperimentelt bestemte tæthed (grå) og -
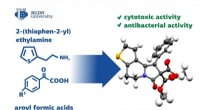 Kemikere udvikler en metode til at syntetisere forbindelser til lægemidlerEt team af kemikere fra RUDN University foreslog en universel metode til syntetisering af thienoindolizin -derivater. På grund af deres særlige egenskaber, disse stoffer kan bruges til fremstilling af
Kemikere udvikler en metode til at syntetisere forbindelser til lægemidlerEt team af kemikere fra RUDN University foreslog en universel metode til syntetisering af thienoindolizin -derivater. På grund af deres særlige egenskaber, disse stoffer kan bruges til fremstilling af -
 Udnyttelse af lys til en soldrevet kemisk industriLektor ved RMIT University Daniel Gomez, holder en skive dækket af det nano-forbedrede palladium. Kredit:RMIT University Ny teknologi, der udnytter sollys til at drive kemiske reaktioner, baner ve
Udnyttelse af lys til en soldrevet kemisk industriLektor ved RMIT University Daniel Gomez, holder en skive dækket af det nano-forbedrede palladium. Kredit:RMIT University Ny teknologi, der udnytter sollys til at drive kemiske reaktioner, baner ve
- Modstandsdygtighed over for klimaændringer? Ny undersøgelse finder, at blæksprutter tilpasser sig…
- Hvad kan hajer lære os om vores hjerter?
- Trump sagde at fremme seismiske tests for olie i atlantiske farvande
- Hvor mange planeter har ringe Hvad har de?
- Digital fotografering:Fremtiden for småproduktion?
- Sætter amerikanske mænd pris på faderskab frem for deres karriere?


