Forskere afslører tydelig substratbindende tilstand i o-succinylbenzoyl-CoA-syntetase
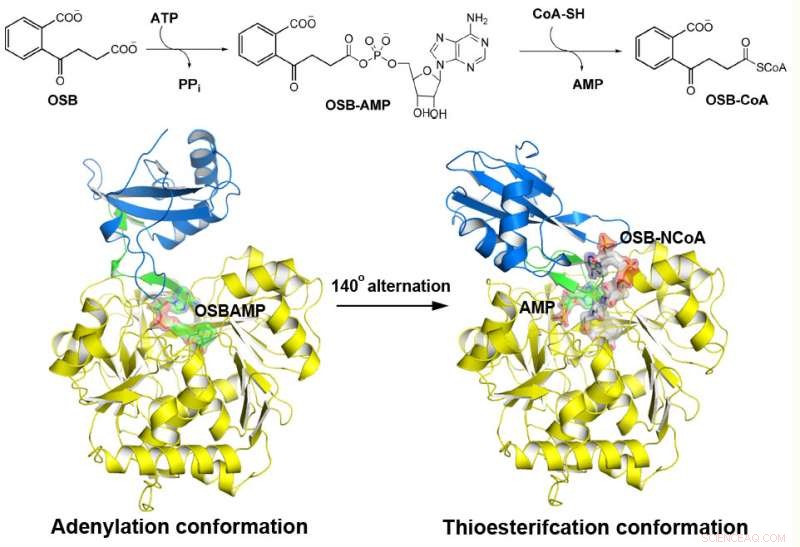
MenE katalyserer en totrinsreaktion i to forskellige strukturer. Kredit:Institut for Kemi, HKUST
o-Succinylbenzoyl-CoA (OSB-CoA) syntetase (MenE) er et essentielt enzym i bakteriel vitamin K-biosyntese og et vigtigt mål i udviklingen af nye antibiotika. Det er medlem af adenylerende enzymer (ANL) familien, som omkonfigurerer deres aktive sted i to forskellige aktive konformationer, den ene for adenyleringens halvreaktion og den anden for en thioesterificering-halvreaktion, i en domæne-alternerende katalytisk mekanisme. Selvom flere aspekter af adenyleringsmekanismen i MenE for nylig er blevet afdækket, dens thioesterificeringskonformation forbliver undvigende.
Ved anvendelse af et katalytisk kompetent Bacillus subtilis mutantprotein kompleksbundet med en OSB-CoA-analog, forskere fra Hong Kong University of Science and Technology afslørede et thioesterificeringsaktivt sted specifikt bevaret blandt MenE-ortologer og en substratbindende tilstand, der adskiller sig fra mange andre acyl/aryl-CoA-syntetaser. Flere rester, der specifikt bidrager til thioesterificeringens halvreaktion uden at påvirke adenyleringens halvreaktion blev identificeret, og de observerede også en væsentlig bevægelse af den aktiverede succinylgruppe i thioesterificeringens halvreaktion.
Deres resultater blev offentliggjort i Journal of Biological Chemistry den 21. juli, 2017.
"Vores resultater giver ny indsigt i domæne-vekslingskatalysen af et bakterieenzym, der er vigtigt for vitamin K-biosyntese, og af dets adenylerende homologer i ANL -enzymfamilien, "sagde Zhihong Guo, en lektor ved Institut for Kemi i HKUST. "Vores arbejde validerede hypotesen om, at en distinkt substratbindingsform er unik for dette enzym."
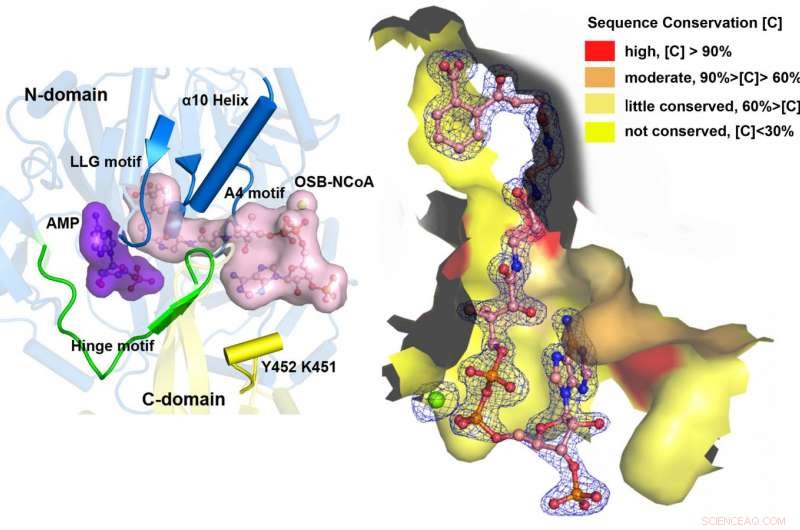
MenE katalyserer en totrinsreaktion i to forskellige strukturer. Kredit:Institut for Kemi, HKUST
Som medlem af ANL -enzymfamilien OSB-CoA-syntetase (MenE) er et værdifuldt lægemiddelmål i vitamin K-biosyntetisk vej, men lidt er kendt om enzymets struktur endnu.
"Vi har konstrueret krystalstrukturer med høj opløsning af en katalytisk kompetent dobbeltmutant (IRAK) af bsMenE i kompleks med en stabil produktanalog, OSB-NCoA, og en kombination af OSB-NCoA og AMP, "sagde Guo." Desuden disse krystalstrukturer afslørede aminosyreresterne, der bidrog til genkendelse og binding af substraterne og produkterne i thioesterificeringsreaktionen. Disse resultater har ikke kun givet entydig støtte til domæne-alternerende katalytiske mekanisme for ANL-enzymer generelt; de har også afsløret det unikke thioesterificeringsaktive sted for OSB-CoA-syntetaser og tilvejebragt det strukturelle grundlag for deres katalyse af thioesterificeringsreaktionen for at lette deres anvendelighed som et lægemiddelmål. "
"Vores fund giver ny indsigt i domæne-alterneringsmekanismen for det essentielle vitamin K-biosyntetiske enzym og dets homologer i ANL-enzymfamilien, og vil hjælpe os med at opbygge en proteinkatalytisk cyklus på en kontinuerlig måde, som ingen har gjort før. "
 Varme artikler
Varme artikler
-
 En hårdere ledende keramik til lavere omkostningerScanningselektronmikrofotografier, der viser (venstre mod højre) de rå Ti-partikler, de fladtrykte Ti-partikler efter formaling, og det endelige sintrede Al 2 O 3 -TiN ledende komposit. Kredit:W.
En hårdere ledende keramik til lavere omkostningerScanningselektronmikrofotografier, der viser (venstre mod højre) de rå Ti-partikler, de fladtrykte Ti-partikler efter formaling, og det endelige sintrede Al 2 O 3 -TiN ledende komposit. Kredit:W. -
 Eddikeeksperiment til endotermiske og eksoterme reaktionerEddike er et af de mest nyttige kemikalier, du finder rundt i huset. Det er dybest set en opløsning med lav koncentration, ca. 5 procent, eddikesyre, som har den kemiske formel C <2H 4O 2, undertide
Eddikeeksperiment til endotermiske og eksoterme reaktionerEddike er et af de mest nyttige kemikalier, du finder rundt i huset. Det er dybest set en opløsning med lav koncentration, ca. 5 procent, eddikesyre, som har den kemiske formel C <2H 4O 2, undertide -
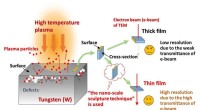 Fusionsforskere har udviklet en skulpturteknik i nanoskalaSkematisk visning af interaktionen mellem plasma og wolfram (til venstre) og forklaring af nødvendigheden af tyndfilmsprøver og den nanoskala skulpturteknik til TEM-observation (højre). Kredit:NIFS
Fusionsforskere har udviklet en skulpturteknik i nanoskalaSkematisk visning af interaktionen mellem plasma og wolfram (til venstre) og forklaring af nødvendigheden af tyndfilmsprøver og den nanoskala skulpturteknik til TEM-observation (højre). Kredit:NIFS -
 Inosin kan være en potentiel vej til det første RNA og livets oprindelse på JordenEt sted i det fjendtlige miljø på den tidlige Jord, livet blev født. Kredit:Harvard University Vores forhistoriske jord, bombarderet med asteroider og lyn, fyldt med boblende geotermiske pools, vi
Inosin kan være en potentiel vej til det første RNA og livets oprindelse på JordenEt sted i det fjendtlige miljø på den tidlige Jord, livet blev født. Kredit:Harvard University Vores forhistoriske jord, bombarderet med asteroider og lyn, fyldt med boblende geotermiske pools, vi
- Klima:Når samfund skal flytte på grund af klimaændringer
- Waymo bringer selvkørende lastbiler til Phoenix-områdets motorveje
- Blue Steel Vs. High Carbon Steel
- Fotoluminescenskontrol af hyperbolske metamaterialer og metaoverflader
- Rutsjebaneforskning landede, næste flyvning:Månen og Mars
- Nye digitaliseringsmetoder og restaureringsteknologier til bevarelse af kulturarven


