Forklar, hvorfor væsker og gasser adskiller sig i densitet Evnen til at blive komprimeret?
densitet:
* væsker: Væsker har molekyler, der er tæt pakket sammen, men de kan stadig bevæge sig rundt. Dette betyder, at de har en højere densitet end gasser.
* Gasser: Gasmolekyler er meget langt fra hinanden og bevæger sig frit i alle retninger. Dette fører til en meget lavere densitet sammenlignet med væsker.
Kompressibilitet:
* væsker: Væsker er relativt ukomprimerbare . Deres molekyler er allerede tæt på hinanden, hvilket giver lidt plads til, at de kan presses nærmere. Forestil dig at prøve at komprimere en fuld flaske vand - det er meget vanskeligt!
* Gasser: Gasser er meget komprimerbare . De store rum mellem gasmolekyler tillader dem at blive presset i et mindre volumen. Tænk på en cykelpumpe - den komprimerer let luft ind i et mindre rum i dækket.
Her er en forenklet analogi:
Forestil dig en overfyldt togstation (væske) og et stort åbent felt (gas).
* densitet: Togstationen er tæt med mennesker, mens marken er tyndt befolket.
* Kompressibilitet: Det er svært at skubbe flere mennesker ind i den overfyldte togstation (ukomprimerbar). Men du kan nemt passe flere mennesker ind i det åbne felt (komprimerbart).
Kortfattet:
Den vigtigste forskel i densitet og kompressibilitet kommer ned til afstand mellem molekyler . Væsker har tæt pakket molekyler, hvilket resulterer i højere densitet og lav kompressibilitet. Gasser har bredt fordelt molekyler, hvilket har ført til lav densitet og høj kompressibilitet.
 Varme artikler
Varme artikler
-
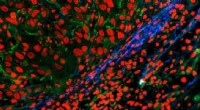 Oplyser vævsdannelse gennem flourescensBillede af tumorgrænse taget ved hjælp af fluorescensmikroskopi. Det nye markørmolekyle viser grænsen for tumoren i blåt; tumorvævet kan ses over det til venstre. Grøn:kollagen, rød:cellekerner. Kredi
Oplyser vævsdannelse gennem flourescensBillede af tumorgrænse taget ved hjælp af fluorescensmikroskopi. Det nye markørmolekyle viser grænsen for tumoren i blåt; tumorvævet kan ses over det til venstre. Grøn:kollagen, rød:cellekerner. Kredi -
 Startup fremmer kulstof-nul brændstoffer gennem UConn-partnerskabMattershift CEO, Rob McGinnis (forrest) og UConn lektor i kemisk og biomedicinsk teknik, Jeff McCutcheon. Kredit:Sean Flynn/UConn Da Rob McGinnis havde brug for et veludstyret laboratorium til sin
Startup fremmer kulstof-nul brændstoffer gennem UConn-partnerskabMattershift CEO, Rob McGinnis (forrest) og UConn lektor i kemisk og biomedicinsk teknik, Jeff McCutcheon. Kredit:Sean Flynn/UConn Da Rob McGinnis havde brug for et veludstyret laboratorium til sin -
 Organiske metalskeletter lavet til at fungere som væskerEn udfordring for holdet var at få en krystallinsk MOF til at opføre sig som en porøs væske. Holdet opdagede, hvordan man modificerer overfladen af relativt store MOF-nanopartikler med passende kemi
Organiske metalskeletter lavet til at fungere som væskerEn udfordring for holdet var at få en krystallinsk MOF til at opføre sig som en porøs væske. Holdet opdagede, hvordan man modificerer overfladen af relativt store MOF-nanopartikler med passende kemi -
 Sådan tager du petroen ud af den petrokemiske industriU of T Engineerings Phil De Luna (MSE PhD 1T9) er hovedforfatter til en artikel i Science, der analyserer, hvordan grøn elektricitet og kulstofopsamling kan fortrænge fossile brændstoffer i produktion
Sådan tager du petroen ud af den petrokemiske industriU of T Engineerings Phil De Luna (MSE PhD 1T9) er hovedforfatter til en artikel i Science, der analyserer, hvordan grøn elektricitet og kulstofopsamling kan fortrænge fossile brændstoffer i produktion
- Svovlforurening fra kul og gas er ekstrem, men ny kemi kunne rydde op
- Hvad er opdelt i 30 sektioner, der bevæger sig rundt på asthenosfæren?
- Hvilke videnskabskoncepter er LED -lælkene baseret på?
- Hvad er en videnskabsmand, der udfører række test, er identisk i enhver henseende for en faktor, s…
- De mørke sider af ekstrasolare planeter deler overraskende lignende temperaturer
- Et biobrændstof til automatiseret varmeproduktion


