Hvorfor har vand som is en køleeffekt?
1. Fusionsvarme: Når is smelter, absorberer den varme fra omgivelserne. Denne absorberede varme kaldes -varmen af fusion , og det er den energi, der kræves for at bryde brintbindingerne, der holder vandmolekylerne i en stiv krystallinsk struktur (ICE) og giver dem mulighed for at bevæge sig mere frit som flydende vand. Denne proces trækker varme væk fra uanset is der er i kontakt med, hvilket får den til at føle sig køligere.
2. Specifik varmekapacitet: Vand har en høj specifik varmekapacitet, hvilket betyder, at det kræver en masse energi at hæve temperaturen på vand med et bestemt beløb. Selvom is er teknisk koldere end flydende vand, har den stadig en høj specifik varmekapacitet. Når du for eksempel lægger is i en drink, tager den energi fra drikken for at hæve isens temperatur til det punkt at smelte. Denne proces afkøler også drikken.
her er en simpel analogi:
Forestil dig, at du holder en varm sten. Stenen overfører varme til din hånd, hvilket får den til at føle sig varm. Forestil dig nu at lægge den varme sten i en spand koldt vand. Vandet absorberer varmen fra stenen, hvilket får stenen til at køle ned, og vandet opvarmes lidt. Vandet har en høj varmekapacitet, så det kan absorbere en masse varme, før dens temperatur ændres markant.
Tilsvarende absorberer is varme fra omgivelserne, hvilket får omgivelserne til at føle sig køligere.
 Varme artikler
Varme artikler
-
 Supermagneter fra en 3-D printerForskerholdet er nu lykkedes med at fremstille miniaturiserede supermagneter ved hjælp af laserbaseret 3D-print. Kredit:IMAT – TU Graz Magnetiske materialer er en vigtig bestanddel af mekatroniske
Supermagneter fra en 3-D printerForskerholdet er nu lykkedes med at fremstille miniaturiserede supermagneter ved hjælp af laserbaseret 3D-print. Kredit:IMAT – TU Graz Magnetiske materialer er en vigtig bestanddel af mekatroniske -
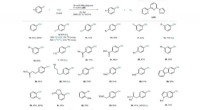 Katalytisk syntese af phenoler med dinitrogenoxidRevalorisering af N2 O som O-kilde i den katalytiske syntese af phenoler. Omfang af aryliodider. [N2 ], N2 detekteret af en gaskromatografi-termisk ledningsevnedetektor ved slutningen af reaktionen.
Katalytisk syntese af phenoler med dinitrogenoxidRevalorisering af N2 O som O-kilde i den katalytiske syntese af phenoler. Omfang af aryliodider. [N2 ], N2 detekteret af en gaskromatografi-termisk ledningsevnedetektor ved slutningen af reaktionen. -
 Det biologisk nedbrydelige batteri, der er 3D-printet, engangs og lavet af papirDet biologisk nedbrydelige batteri består af fire lag, alle flyder ud af en 3D-printer efter hinanden. Det hele bliver så foldet sammen som en sandwich, med elektrolytten i midten. Billede:Gian Vaitl
Det biologisk nedbrydelige batteri, der er 3D-printet, engangs og lavet af papirDet biologisk nedbrydelige batteri består af fire lag, alle flyder ud af en 3D-printer efter hinanden. Det hele bliver så foldet sammen som en sandwich, med elektrolytten i midten. Billede:Gian Vaitl -
 Realtidsovervågningsværktøj fremskynder avanceret udvikling af atomreaktorerAmanda Lines, en PNNL kemiker, udvikler overvågningsværktøjer i realtid for at bane vejen for hurtigere avanceret reaktortestning og design. Kredit:Andrea Starr | Pacific Northwest National Laboratory
Realtidsovervågningsværktøj fremskynder avanceret udvikling af atomreaktorerAmanda Lines, en PNNL kemiker, udvikler overvågningsværktøjer i realtid for at bane vejen for hurtigere avanceret reaktortestning og design. Kredit:Andrea Starr | Pacific Northwest National Laboratory


