Hvad vil der ske med smeltepunktet for is, hvis der tilføjes noget almindeligt salt?
Her er hvorfor:
* frysningspunktdepression: Tilsætningen af et opløst stof (som salt) til et opløsningsmiddel (som vand) sænker opløsningsmidlets frysepunkt. Dette er kendt som frysepunktdepression.
* Forstyrrelse af vandmolekyler: Salt opløses i vand og skaber ioner (natrium- og chloridioner i dette tilfælde). Disse ioner forstyrrer den normale hydrogenbinding mellem vandmolekyler, hvilket gør det sværere for vandmolekylerne at danne den regelmæssige, krystallinske isstruktur.
* lavere energi krævet: Som et resultat kræves en lavere temperatur for at fryse vandet. Omvendt vil isen smelte ved en lavere temperatur end ren is.
Praktisk eksempel: Dette er grunden til, at salt bruges til at smelte is på veje om vinteren. Salt sænker vandets frysepunkt, hvilket får det til at smelte, selv ved temperaturer under 0 ° C (32 ° F).
Sidste artikelFlyder stykker is i saltvand?
Næste artikelHvad sker der med isens temperatur, når du tilsættes noget salt?
 Varme artikler
Varme artikler
-
 Printede perovskite LED'erGrafisk repræsentation af udskrivningsprocessen for perovskite LED. Kredit:Claudia Rothkirch/HU Berlin Mikroelektronik anvender forskellige funktionelle materialer, hvis egenskaber gør dem velegne
Printede perovskite LED'erGrafisk repræsentation af udskrivningsprocessen for perovskite LED. Kredit:Claudia Rothkirch/HU Berlin Mikroelektronik anvender forskellige funktionelle materialer, hvis egenskaber gør dem velegne -
 Bestemmelse af mængden og placeringen af lipider i hjernenJonathan Sweedler er interesseret i analytisk neurokemi og studerer fordelingen af neurotransmittere. Kredit:Della Perrone for Beckman Institute for Advanced Science and Technology. Forskere ved
Bestemmelse af mængden og placeringen af lipider i hjernenJonathan Sweedler er interesseret i analytisk neurokemi og studerer fordelingen af neurotransmittere. Kredit:Della Perrone for Beckman Institute for Advanced Science and Technology. Forskere ved -
 Carbon nanokompositter er nu et skridt tættere på praktisk industriCarbon-nanokomposit efter afslutning af støbeprocessen. Prøven vil blive testet for piezoresistiv respons efter mindre efterbehandling. Disse materialer kan formes til næsten enhver størrelse og form.
Carbon nanokompositter er nu et skridt tættere på praktisk industriCarbon-nanokomposit efter afslutning af støbeprocessen. Prøven vil blive testet for piezoresistiv respons efter mindre efterbehandling. Disse materialer kan formes til næsten enhver størrelse og form. -
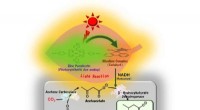 Succes med at syntetisere bionedbrydelige plastmaterialer ved hjælp af sollys og CO2Syntet lys-drevet 3-hydroxybutyrat-produktion fra acetone og CO2:Ved hjælp af sollys og biokatalysatorer syntetiserede Osaka Metropolitan University-forskere 3-hydroxybutyrat, et biologisk nedbrydelig
Succes med at syntetisere bionedbrydelige plastmaterialer ved hjælp af sollys og CO2Syntet lys-drevet 3-hydroxybutyrat-produktion fra acetone og CO2:Ved hjælp af sollys og biokatalysatorer syntetiserede Osaka Metropolitan University-forskere 3-hydroxybutyrat, et biologisk nedbrydelig
- Hvad er sloganerne til landbeskyttelse?
- Teoretiske fysikere forudsiger kvanteinteraktioner inden for 3D-molekyler
- Sådan arbejder designerbørn
- Hvad forårsager friktion mellem to tilsyneladende glatte overflader?
- Hvorfor er CO2 en drivhusgas?
- Liberal? Konservativ? Stanford-undersøgelse siger, at mentale skub kan få vælgerne til at flip-fl…


