Retningen i whick En reversibel reaktion vil fortsætte kan forudsiges ud fra lovene i?
Her er hvordan:
* Gibbs Free Energy Change (ΔG): Dette er det vigtigste termodynamiske koncept til forudsigelse af reaktionsretning. En negativ ΔG indikerer en spontan reaktion, hvilket betyder, at den vil fortsætte i den forreste retning. En positiv ΔG indikerer en ikke-spontan reaktion i fremad retning, hvilket betyder, at den vil fortsætte i omvendt retning. En ΔG af nul indikerer ligevægt.
* entalpiændring (ΔH): Dette fortæller os om reaktionens varmestrøm.
* Eksotermiske reaktioner (ΔH <0) frigørelsesvarme og foretrækkes ofte ved lavere temperaturer.
* Endotermiske reaktioner (ΔH> 0) absorberer varme og favoriseres ofte ved højere temperaturer.
* entropiændring (ΔS): Dette fortæller os om ændringen i lidelsen eller tilfældigheden af systemet.
* En stigning i entropi (ΔS> 0) favoriseres ofte, især ved højere temperaturer.
Kortfattet:
Retningen af en reversibel reaktion bestemmes i sidste ende af Gibbs frie energiændring, som er påvirket af entalpiændringen, entropiændring og temperatur. Ved at analysere disse faktorer kan vi forudsige, om en reaktion vil favorisere den fremadgående eller omvendte retning under givne betingelser.
 Varme artikler
Varme artikler
-
 En naturinspireret belægning for at forhindre, at stoffer nedbrydes for tidligtForskere har udviklet en tynd belægning, der kan gøre det muligt for medicin at have færre tilsætningsstoffer. Kredit:Shutterstock.com Kemikere har udviklet en belægning, der kan gøre visse lægemi
En naturinspireret belægning for at forhindre, at stoffer nedbrydes for tidligtForskere har udviklet en tynd belægning, der kan gøre det muligt for medicin at have færre tilsætningsstoffer. Kredit:Shutterstock.com Kemikere har udviklet en belægning, der kan gøre visse lægemi -
 Skinnende røntgenlys på perovskiter for bedre solcellerKredit:CC0 Public Domain Opkaldt efter et mineral opdaget i Uralbjergene i Rusland, perovskites har taget i centrum som en klasse af materialer med egenskaber, der kan anvendes på fremtidige elekt
Skinnende røntgenlys på perovskiter for bedre solcellerKredit:CC0 Public Domain Opkaldt efter et mineral opdaget i Uralbjergene i Rusland, perovskites har taget i centrum som en klasse af materialer med egenskaber, der kan anvendes på fremtidige elekt -
 Brintøkonomi med masseproduktion af højrent brint fra ammoniakAmmoniakbaseret brintekstraktionsanordning. Kredit:Korea Institute of Science and Technology (KIST) Korea Institute of Science and Technology (KIST) har udsendt en meddelelse om teknologien til at
Brintøkonomi med masseproduktion af højrent brint fra ammoniakAmmoniakbaseret brintekstraktionsanordning. Kredit:Korea Institute of Science and Technology (KIST) Korea Institute of Science and Technology (KIST) har udsendt en meddelelse om teknologien til at -
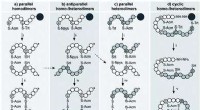 Bioinspirerede strategier til udvikling af nye lægemidlerFig. 1 Syntetiske strategier mod parallelle, antiparallelle og cykliske to-disulfidbindingshomo- og heterodimerer af VP/OT. Anvendte ortogonale beskyttelsesgrupper:Acm, acetamidomethyl; Npys, 3-nitro
Bioinspirerede strategier til udvikling af nye lægemidlerFig. 1 Syntetiske strategier mod parallelle, antiparallelle og cykliske to-disulfidbindingshomo- og heterodimerer af VP/OT. Anvendte ortogonale beskyttelsesgrupper:Acm, acetamidomethyl; Npys, 3-nitro
- Er røde himmel om natten en hyrders glæde? En astronoms opfattelse
- Hvad sker der, når nogen dør i rummet? Rumturisme bringer nye juridiske og moralske spørgsmål
- NASA-observationer finder, hvad der hjælper med at opvarme mosrødder på solen
- Næste generation af syntetiske kovalente 2-D materialer afsløret
- Thailændere tilskynder Kina-ledede plan om at uddybe Mekong-floden
- Kan en kation og anion være isoelektronisk fra samme periode?


