Hvorfor koncentration er vigtig i en kemisk reaktion?
1. Kollisionsteori: Kemiske reaktioner forekommer, når reaktantmolekyler kolliderer med tilstrækkelig energi og korrekt orientering. Højere koncentration betyder, at flere molekyler er til stede i et givet volumen, hvilket øger chancerne for vellykkede kollisioner.
2. Reaktionshastighed: Koncentration påvirker direkte hastigheden for en kemisk reaktion. Højere koncentration fører til en hurtigere reaktionshastighed, fordi flere reaktantmolekyler er tilgængelige til at kollidere og reagere.
3. Ligevægt: For reversible reaktioner spiller koncentration en afgørende rolle i bestemmelsen af ligevægtspositionen. Le Chateliers princip siger, at et system i ligevægt vil skifte for at lindre stress. Ændring af koncentrationen af reaktanter eller produkter vil få systemet til at skifte til favorit den side, der reducerer stresset.
4. Reaktionsudbytte: Mængden af produkt, der er dannet i en reaktion, afhænger af koncentrationen af reaktanter. Højere koncentrationer fører normalt til højere udbytter, da flere reaktantmolekyler er tilgængelige til at reagere.
5. Støkiometri: Den afbalancerede kemiske ligning for en reaktion viser de molforhold mellem reaktanter og produkter. Koncentration giver os mulighed for at beregne mængderne af reaktanter og produkter, der er involveret i en bestemt reaktion.
Eksempler:
* forbrænding: Mere ilt i luften (højere koncentration) får en brand til at brænde mere intenst.
* enzymkatalyse: Koncentrationen af substrat (molekylet, som enzymet virker på) påvirker hastigheden for enzymaktivitet.
* syre-base-reaktioner: Styrken af en syre eller base bestemmes af dens koncentration (målt som molaritet).
Kortfattet: Koncentration er en kritisk faktor i kemiske reaktioner, fordi den påvirker hyppigheden af kollisioner, reaktionshastigheden, ligevægtspositionen, reaktionsudbyttet og den samlede støkiometri af reaktionen.
 Varme artikler
Varme artikler
-
 Hvorfor er visse tungmetaller okay at spise? (video)Kredit:The American Chemical Society Tungmetaller har ry for at være farlige, men nogle er essentielle næringsstoffer, som du ikke kan leve uden. I denne uges afsnit af Reaktioner , undersøger vi h
Hvorfor er visse tungmetaller okay at spise? (video)Kredit:The American Chemical Society Tungmetaller har ry for at være farlige, men nogle er essentielle næringsstoffer, som du ikke kan leve uden. I denne uges afsnit af Reaktioner , undersøger vi h -
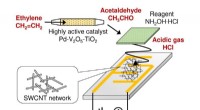 Udvikling af en lille sensor, der er i stand til løbende at overvåge phytohormon ethylenEn lille, meget følsom sensor, der er i stand til at detektere ethylen med stor selektivitet. Kredit:NIMS NIMS og AIST har udviklet en lille sensor, der er i stand til kontinuerligt at overvåge pl
Udvikling af en lille sensor, der er i stand til løbende at overvåge phytohormon ethylenEn lille, meget følsom sensor, der er i stand til at detektere ethylen med stor selektivitet. Kredit:NIMS NIMS og AIST har udviklet en lille sensor, der er i stand til kontinuerligt at overvåge pl -
 Forskere forstår endelig enzymernes arbejdsugeKredit:Københavns Universitet Enzymer bruges meget i vores hverdag. Som små soldater, enzymer i vaskepulver arbejder for at fjerne fedtpletter fra tøj, ligesom de bruges til at omdanne halm til bi
Forskere forstår endelig enzymernes arbejdsugeKredit:Københavns Universitet Enzymer bruges meget i vores hverdag. Som små soldater, enzymer i vaskepulver arbejder for at fjerne fedtpletter fra tøj, ligesom de bruges til at omdanne halm til bi -
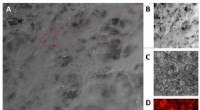 Mere realistiske og nøjagtige organer-på-chipsKredit:American Chemical Society I et skridt mod bedre diagnosticering og behandling af fordøjelsesproblemer, såsom inflammatorisk tarmsygdom, videnskabsmænd rapporterer i ACS Biomaterials &Engin
Mere realistiske og nøjagtige organer-på-chipsKredit:American Chemical Society I et skridt mod bedre diagnosticering og behandling af fordøjelsesproblemer, såsom inflammatorisk tarmsygdom, videnskabsmænd rapporterer i ACS Biomaterials &Engin
- Computermodeller viser, hvor dybt kulstof kan vende tilbage til Jordens overflade
- Surfer over simulerede krusninger i grafen
- Hvilket grundstof er der i svovlsyre saltpetersyre og ethansyre?
- Mikrokirurgi og Superlim viser, hvordan antenner hjælper mølnavigation
- Hvorfor er metal skrig, når det tåler tør is?
- A dåse indeholder en blanding af 2 væsker og B i forhold 75, når 9 liter trækkes er fyldt med væ…


