Hvor mange mol CO2 dannes, når 58 gram butan C4H10 brænder i ilt?
1. Skriv den afbalancerede kemiske ligning:
2 C₄H₁₀ + 13 O₂ → 8 CO₂ + 10 H₂O
2. Beregn den molære masse af butan (C₄H₁₀):
Molmasse på C =12,01 g/mol
Molmasse på H =1,01 g/mol
Molmasse af c₄h₁₀ =(4 * 12.01) + (10 * 1,01) =58,12 g/mol
3. Konverter gram af butan til mol:
Mol C₄H₁₀ =(58 g) / (58,12 g / mol) =1 mol
4. Brug molforholdet fra den afbalancerede ligning:
Den afbalancerede ligning viser, at 2 mol C₄H₁₀ producerer 8 mol co₂. Derfor er molforholdet 2:8 eller 1:4.
5. Beregn mol af co₂ produceret:
Mol co₂ =(1 mol c₄h₁₀) * (4 mol co₂ / 1 mol c₄h₁₀) =4 mol co₂
Svar: 4 mol co₂ dannes, når 58 gram butan brænder i ilt.
 Varme artikler
Varme artikler
-
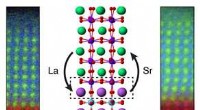 Udnyttelse af tabte atomer kan hjælpe med at skabe nye, aldrig før sete oxiderKemisk kortlægning og illustration af atomare omlejring ved grænsefladen mellem to oxidmaterialer (La =lanthan; Sr =strontium). Kredit:PNNL At forstå, hvordan materialer dannes og kombineres med h
Udnyttelse af tabte atomer kan hjælpe med at skabe nye, aldrig før sete oxiderKemisk kortlægning og illustration af atomare omlejring ved grænsefladen mellem to oxidmaterialer (La =lanthan; Sr =strontium). Kredit:PNNL At forstå, hvordan materialer dannes og kombineres med h -
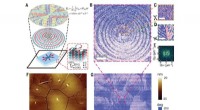 Koncentriske cirkulære polariseringsbånd fundet i en ferroelektrisk polymerObservation af toroidal polær topologi. Kredit: Videnskab (2021). DOI:10.1126/science.abc4727 Et team af forskere fra Kina, USA og Australien har fundet et eksempel på dannelsen af koncentriske
Koncentriske cirkulære polariseringsbånd fundet i en ferroelektrisk polymerObservation af toroidal polær topologi. Kredit: Videnskab (2021). DOI:10.1126/science.abc4727 Et team af forskere fra Kina, USA og Australien har fundet et eksempel på dannelsen af koncentriske -
 Kemikere opfinder en ny Lewis surhedstest ved hjælp af fluorescensKredit:York University York University kemikere har opfundet en ny fluorescens-baseret metode til nøjagtigt at bestemme styrken af en række Lewis-syrer, som en dag kunne bruges til at hjælpe med
Kemikere opfinder en ny Lewis surhedstest ved hjælp af fluorescensKredit:York University York University kemikere har opfundet en ny fluorescens-baseret metode til nøjagtigt at bestemme styrken af en række Lewis-syrer, som en dag kunne bruges til at hjælpe med -
 Nøjagtig bestemmelse af energiniveauerne for forskellige solceller til højtydende enhedera) Energiniveauer for organiske halvledere målt ved hjælp af UPS, LE-IPES og CV. b,c) Plot, der viser sammenhængen mellem Eoxd og IE (målt via UPS) (b), og Erød og EA (målt via LE-IPES) (c) af donorpo
Nøjagtig bestemmelse af energiniveauerne for forskellige solceller til højtydende enhedera) Energiniveauer for organiske halvledere målt ved hjælp af UPS, LE-IPES og CV. b,c) Plot, der viser sammenhængen mellem Eoxd og IE (målt via UPS) (b), og Erød og EA (målt via LE-IPES) (c) af donorpo
- Mars-forsker forklarer, hvorfor NASA valgte Gale Crater som ny rover
- Forhistoriske kvinder var succesrige storvildtjægere, udfordrende overbevisninger om gamle kønsrol…
- Sådan fremstilles en 3D-model af Sodium
- Hvilken skade forårsager vulkanen i Island?
- Navn 2 -celleorganeller har DNA?
- Individuelle klimamodeller giver muligvis ikke det komplette billede


