Hvor mange mol er indeholdt i 4,67 L -prøve af gas 33 grader celsius og 199 kPa?
1. Konverter enheder:
* temperatur (t): Konverter Celsius til Kelvin:33 ° C + 273,15 =306,15 K
* tryk (p): Konverter KPA til atmosfærer (ATM):199 KPa * (1 atm / 101.325 kPa) =1,96 atm
2. Brug den ideelle gaslov:
Den ideelle gaslov er:PV =NRT
Hvor:
* P =pres (i ATM)
* V =volumen (i liter)
* n =antal mol
* R =ideel gaskonstant (0,0821 l⋅atm/mol⋅k)
* T =temperatur (i Kelvin)
3. Løs for 'n' (antal mol):
Omarranger den ideelle gaslov til at løse for 'n':
n =pv / rt
4. Tilslut værdierne og bereg:
n =(1,96 atm * 4,67 l) / (0,0821 l⋅atm / mol⋅k * 306,15 K)
n ≈ 0,364 mol
Derfor indeholder 4,67 L -prøven ca. 0,364 mol.
Sidste artikelHvor mange mol er der i 45 g F?
Næste artikelHvor mange mol fluor i 3 borontrifluorid?
 Varme artikler
Varme artikler
-
 Superfleksible aerogeler er meget effektive absorbenter, termiske isolatorer, og tryksensorerKredit:Wiley Luftig, Luftigere, Aerogel. Indtil nu, skørhed har begrænset den praktiske anvendelse af disse sarte faste stoffer, som næsten udelukkende består af luftfyldte porer. Dette kan nu ænd
Superfleksible aerogeler er meget effektive absorbenter, termiske isolatorer, og tryksensorerKredit:Wiley Luftig, Luftigere, Aerogel. Indtil nu, skørhed har begrænset den praktiske anvendelse af disse sarte faste stoffer, som næsten udelukkende består af luftfyldte porer. Dette kan nu ænd -
 Planteinspirerede alkaloider beskytter ris, kiwi og citrus fra skadelige bakterierKredit:Pixabay/CC0 Public Domain Planter får bakterielle infektioner, ligesom mennesker gør. Når madafgrøder og træer er inficeret, deres udbytte og kvalitet kan lide. Selvom nogle forbindelser er
Planteinspirerede alkaloider beskytter ris, kiwi og citrus fra skadelige bakterierKredit:Pixabay/CC0 Public Domain Planter får bakterielle infektioner, ligesom mennesker gør. Når madafgrøder og træer er inficeret, deres udbytte og kvalitet kan lide. Selvom nogle forbindelser er -
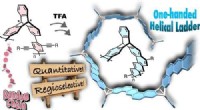 Syntese af spiralformede stigepolymererRapport:En effektiv syntese af optisk aktive stige-type molekyler og polymerer gennem intramolekylær ringslutning af chirale triptycener indeholdende bis[2-(4-alkoxyphenyl)ethynyl]phenylenenheder. De
Syntese af spiralformede stigepolymererRapport:En effektiv syntese af optisk aktive stige-type molekyler og polymerer gennem intramolekylær ringslutning af chirale triptycener indeholdende bis[2-(4-alkoxyphenyl)ethynyl]phenylenenheder. De -
 Hvad er det hvide på min påskechokolade, og kan jeg stadig spise det?Kredit:Shutterstock Ordene chokolade og skuffelse går ikke ofte sammen. Men du har måske oplevet en vis skuffelse, hvis du nogensinde har pakket den lyse folie af et påskeæg ud for at opdage hvid,
Hvad er det hvide på min påskechokolade, og kan jeg stadig spise det?Kredit:Shutterstock Ordene chokolade og skuffelse går ikke ofte sammen. Men du har måske oplevet en vis skuffelse, hvis du nogensinde har pakket den lyse folie af et påskeæg ud for at opdage hvid,
- Floder varmes op i samme hastighed som atmosfæren
- Epitaksialt dyrket molybdænoxid udvikler sig som et bulk-lignende 2-D dielektrisk lag
- Sådan fungerer millimeterbølgescannere
- Her ser på dug:edderkopper snarer vand fra luften
- Er Pledge en syre eller en base?
- Catch-22 i grafenbaserede molekylære enheder løst


