Atomer af elementer i en gruppe på den periodiske tabel har lignende kemiske egenskaber Denne lighed er mest relateret til atomer?
Her er hvorfor:
* Valenselektroner: Dette er elektronerne i det yderste energiniveau af et atom. Det er dem, der er involveret i kemisk binding.
* Gruppendenser: Elementer inden for den samme gruppe har det samme antal valenselektroner. For eksempel har alle elementer i gruppe 1 (alkalimetaller) en valenselektron, og alle elementer i gruppe 17 (halogener) har syv valenselektroner.
* Kemisk opførsel: Antallet af valenselektroner bestemmer, hvordan et atom vil interagere med andre atomer, hvilket fører til lignende kemiske egenskaber.
Eksempel:
* lithium (Li) og natrium (NA) , begge i gruppe 1, har en valenselektron. Dette gør dem meget reaktive, ivrige efter at miste det elektron til at danne en +1 ion og deltage i ionisk binding.
* fluor (f) og klor (Cl) , begge i gruppe 17, har syv valenselektroner. De har en tendens til at få et elektron for at opnå en stabil oktet og danne en -1 -ion, der også deltager i ionisk binding.
Derfor er antallet af valenselektroner den nøglefaktor, der driver de lignende kemiske egenskaber af elementer i en gruppe på den periodiske tabel.
Sidste artikelHvad er massen af en prøve natrium, der indeholder 2980 atomer?
Næste artikelHvilken proces ændrer gas til fast?
 Varme artikler
Varme artikler
-
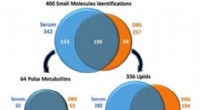 I longitudinelle undersøgelser, tørrede blodpletprøver spiller en rolleVenn -diagrammer illustrerer antallet af serum- og DBS -småmolekyleidentifikationer og overlapningen mellem prøvetyperne. De små molekyler blev adskilt i polære metabolit- og lipididentifikationer og
I longitudinelle undersøgelser, tørrede blodpletprøver spiller en rolleVenn -diagrammer illustrerer antallet af serum- og DBS -småmolekyleidentifikationer og overlapningen mellem prøvetyperne. De små molekyler blev adskilt i polære metabolit- og lipididentifikationer og -
 Del og erobre:Forskere finder nøglen til at skabe bedre medicin med færre bivirkningerChiralt molekyle. Kredit:Palitel og Naaman. I dag, en ny undersøgelse offentliggjort i Videnskab af professorer Yossi Paltiel fra det hebraiske universitet i Jerusalem og Ron Naaman fra Weizmann
Del og erobre:Forskere finder nøglen til at skabe bedre medicin med færre bivirkningerChiralt molekyle. Kredit:Palitel og Naaman. I dag, en ny undersøgelse offentliggjort i Videnskab af professorer Yossi Paltiel fra det hebraiske universitet i Jerusalem og Ron Naaman fra Weizmann -
 Atombilleder afslører mange naboer for nogle iltatomerBilleder af ilt (øverste række) og nitrogenatomer (nederste række) i et kulstofnetværk, optaget på mikroskopilaboratoriet ved universitetet i Wien. Blandt de forventede konfigurationer, ilt findes ogs
Atombilleder afslører mange naboer for nogle iltatomerBilleder af ilt (øverste række) og nitrogenatomer (nederste række) i et kulstofnetværk, optaget på mikroskopilaboratoriet ved universitetet i Wien. Blandt de forventede konfigurationer, ilt findes ogs -
 Detektering af et hidtil uset udvalg af potentielt skadelige luftbårne forbindelserDette bærbare badge i kreditkortstørrelse indeholder en ny type silica, der låser sig på en lang række VOCer. Kredit:Airotect Mange af de produkter, vi møder dagligt – fra deodorant til pesticider
Detektering af et hidtil uset udvalg af potentielt skadelige luftbårne forbindelserDette bærbare badge i kreditkortstørrelse indeholder en ny type silica, der låser sig på en lang række VOCer. Kredit:Airotect Mange af de produkter, vi møder dagligt – fra deodorant til pesticider
- Adopter et oliventræ - og pust nyt liv i den spanske landsby
- Verdens største bølger:Hvordan klimaændringer kan udløse store jordskred og 'mega-tsunamier'
- God planlægning får cyklen til at rulle:Ny tilgang til planlægning af cykelinfrastruktur
- Frygten for forværring af Indien oversvømmelser, da voldsomme regnskyl ødelægger
- Forskere tager et dybt dyk ned i, hvordan hajer bruger havet
- Hvilken romersk videnskabsmand sagde, at jorden var universets centrum?


