Hvad gør reduktionsmidler under redoxreaktioner?
1. Doner elektroner: Reduktion af midler er stoffer, der mister elektroner i en kemisk reaktion. Tænk på dem som generøse donorer og giver deres elektroner væk til en anden art.
2. Bliv oxideret: Fordi de mister elektroner, bliver reduktionsmidler selv oxideret . Dette betyder, at deres oxidationstilstand øges (bliver mere positive).
3. Reducer andre arter: De elektroner, der er doneret af reduktionsmidlet, accepteres af en anden art, hvilket får denne art til at få elektroner . Denne proces kaldes reduktion , derfor navnet "Reducerende agent".
Eksempel: I reaktionen mellem zink og kobber (II) -ioner:
Zn (S) + Cu²⁺ (aq) → Zn²⁺ (aq) + cu (s)
* zink (Zn) er det reducerende middel. Det mister to elektroner og bliver oxideret til Zn²⁺.
* kobber (II) ioner (cu²⁺) er det oxiderende middel. De får to elektroner og bliver reduceret til kobbermetal (Cu).
Kortfattet: Reduktion af midler er elektrondonorerne i redoxreaktioner. De oxideres sig selv, mens de reducerer en anden art ved at tilvejebringe elektroner.
Sidste artikelHvilke gas producerer kemiske leadere for at lette bagværk?
Næste artikelEr molekyler af H2O tættere sammen i damp end vand?
 Varme artikler
Varme artikler
-
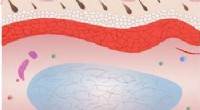 Hydrogel heler uden tilsætningsstofferEn illustration viser, hvordan over seks uger, fra top til bund, en hydrogel, der er udviklet ved Rice University, hjælper med vævsremodellering. Processen begynder med celleinfiltration efterfulgt af
Hydrogel heler uden tilsætningsstofferEn illustration viser, hvordan over seks uger, fra top til bund, en hydrogel, der er udviklet ved Rice University, hjælper med vævsremodellering. Processen begynder med celleinfiltration efterfulgt af -
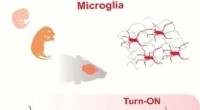 Visualisering af mikroglia i hjernevæv med et fluorescens tændt substratKredit:Angewandte Chemie International Edition En del af immunsystemet i hjernen består af såkaldte mikrogliaceller. Koreanske og singaporeanske forskere har nu udviklet en fluorescerende sonde, d
Visualisering af mikroglia i hjernevæv med et fluorescens tændt substratKredit:Angewandte Chemie International Edition En del af immunsystemet i hjernen består af såkaldte mikrogliaceller. Koreanske og singaporeanske forskere har nu udviklet en fluorescerende sonde, d -
 Lean elektrolytdesign er en game-changer for magnesiumbatterierUniversity of Houston forskere Yan Yao, venstre, Hui Dong og Yanliang Leonard Liang ledede et projekt for at forbedre ydeevnen af magnesiumbatterier. Kredit:University of Houston Forskere fra Un
Lean elektrolytdesign er en game-changer for magnesiumbatterierUniversity of Houston forskere Yan Yao, venstre, Hui Dong og Yanliang Leonard Liang ledede et projekt for at forbedre ydeevnen af magnesiumbatterier. Kredit:University of Houston Forskere fra Un -
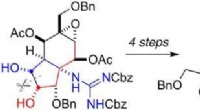 Fremstilling af pufferfisktoksin i en kolbeKredit:Angewandte Chemie I Japan, puffer fisk betragtes som en delikatesse, men kildren til smagsløgene kommer med en kildren til nerverne:fugu indeholder tetrodotoxin, et stærkt nervegift. I lave
Fremstilling af pufferfisktoksin i en kolbeKredit:Angewandte Chemie I Japan, puffer fisk betragtes som en delikatesse, men kildren til smagsløgene kommer med en kildren til nerverne:fugu indeholder tetrodotoxin, et stærkt nervegift. I lave
- Hvor mange kulstof- og brintatomer indeholder decan?
- Direkte syntese af isoparaffinrig benzin fra syngas
- Billige nanopartikler stimulerer immunrespons på kræft i laboratoriet
- Hvad skete der med Bidens gratis college-plan? Reducere omkostningerne ved højere ed uden for Feds …
- Hvordan lægger slanger æg?
- Hvorfor er et vibrerende elektrisk felt et eksempel på en elektromagnetisk bølge?


