Bestemmer elektronet reaktivitet af et atom?
Elektroner og reaktivitet:
* Valenselektroner: Elektronerne i den yderste skal (Valence Shell) er dem, der er involveret i kemisk binding. Det er dem, der bestemmer, hvordan et atom vil interagere med andre atomer.
* Elektronkonfiguration: Det specifikke arrangement af elektroner i en atoms skaller og underskaller (elektronkonfiguration) påvirker dens reaktivitet. Atomer med en fuld valensskal (som ædelgasser) er meget stabile og ureaktive. Atomer med en eller et par manglende elektroner i deres valensskal har en tendens til at være meget reaktive.
* Elektronegativitet: Denne egenskab afspejler, hvor stærkt et atom tiltrækker elektroner i en binding. Meget elektronegative atomer har en tendens til at være mere reaktive, da de er mere tilbøjelige til at vinde elektroner og danne anioner.
Andre faktorer, der påvirker reaktivitet:
* atomafgift: Antallet af protoner i kernen påvirker attraktionen for elektroner. En højere atomafgift fører generelt til stærkere tiltrækning for elektroner, hvilket gør atomet mere reaktivt.
* atomstørrelse: Mindre atomer har en tendens til at være mere reaktive, da deres valenselektroner er tættere på kernen og lettere tilgængelige til binding.
Kortfattet:
Elektronens rolle i reaktivitet er kompleks og mangefacetteret. Det er ikke kun selve elektronet, men dets konfiguration, atomets elektronegativitet og andre faktorer, der i sidste ende bestemmer, hvor reaktivt et atom vil være.
 Varme artikler
Varme artikler
-
 Samhørighedsforskere afslører mysteriet om brintvirkninger på materialerFig. 1. Total hydrogenfordeling i stål efter 3% trækbelastning belastning svarende til hydrogentryk på (a) 1 bar, (b) 100 bar, (c) 200 bar og (d) 1000 bar. Kredit:Delft University of Technology Br
Samhørighedsforskere afslører mysteriet om brintvirkninger på materialerFig. 1. Total hydrogenfordeling i stål efter 3% trækbelastning belastning svarende til hydrogentryk på (a) 1 bar, (b) 100 bar, (c) 200 bar og (d) 1000 bar. Kredit:Delft University of Technology Br -
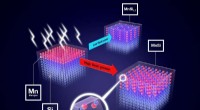 Særlig varmebehandling forbedrer nyt magnetisk materialeHvis forskerne varierer blinkens magt, de kan præcist påvirke forholdet mellem de forskellige krystalfaser. Kredit:HZDR/Juniks Skyrmions - små magnetiske hvirvler - betragtes som lovende kandidate
Særlig varmebehandling forbedrer nyt magnetisk materialeHvis forskerne varierer blinkens magt, de kan præcist påvirke forholdet mellem de forskellige krystalfaser. Kredit:HZDR/Juniks Skyrmions - små magnetiske hvirvler - betragtes som lovende kandidate -
 Forskere forbedrer processen til at omdanne svært genanvendeligt plastikaffald til brændstofHilal Ezgi Toraman, Virginia S. og Philip L. Walker Jr. Fakultetsstipendiat i John og Willie Leone Family Department of Energy and Mineral Engineering i Penn State. Kredit:Penn State University At
Forskere forbedrer processen til at omdanne svært genanvendeligt plastikaffald til brændstofHilal Ezgi Toraman, Virginia S. og Philip L. Walker Jr. Fakultetsstipendiat i John og Willie Leone Family Department of Energy and Mineral Engineering i Penn State. Kredit:Penn State University At -
 Forskere udvikler molekylært termometer til kontaktløs måling ved hjælp af infrarødt lysDen molekylære rubin i fast (rød) og opløst (gul) tilstand kan bruges til kontaktløs måling af temperatur. Kredit:Sven Otto, JGU Kemikere ved Johannes Gutenberg University Mainz (JGU) har i samarb
Forskere udvikler molekylært termometer til kontaktløs måling ved hjælp af infrarødt lysDen molekylære rubin i fast (rød) og opløst (gul) tilstand kan bruges til kontaktløs måling af temperatur. Kredit:Sven Otto, JGU Kemikere ved Johannes Gutenberg University Mainz (JGU) har i samarb
- Mange gasgigantiske exoplaneter venter på at blive opdaget
- Team opdager forholdet mellem DNA-replikationstidspunkt og hvordan gener foldes ind i 3D-strukturer …
- Hvilken måling påvirkes af tyngdekraften?
- Portugals skovbrand ulmer som de første ofre begravet
- Hvad forårsager jordskælvsforskælv?
- Hvad er volumenet af en pyramide 5 meter høj, hvis dens base firkant 4 ved fødderne?


