Hvordan bestemmer du, hvor reaktivt et element er baseret på sit atomnummer?
Hvorfor atomnummer alene er ikke nok
* Elektronkonfiguration: Reaktivitet drives primært af et elements ønske om at opnå en stabil elektronkonfiguration (normalt en fuld ydre skal). Atomnummer fortæller dig antallet af protoner, men det afslører ikke direkte arrangementet af elektroner.
* Valenselektroner: Elektronerne i den yderste skal (valenselektroner) er dem, der er involveret i kemisk binding og dermed reaktivitet. Atomnummer fortæller dig ikke direkte, hvor mange valenselektroner et element har.
* ioniseringsenergi og elektronaffinitet: Disse egenskaber, der vedrører let at fjerne eller vinde elektroner, er vigtige faktorer i reaktivitet. Disse er påvirket af faktorer som elektronafskærmning, atomafgift og antallet af elektronskaller, som ikke er direkte bestemt af atomnummer alene.
hvordan man overvejer reaktivitet med atomnummer
1. Periodiske tendenser: Atomnummer er afgørende for at forstå reaktivitet, fordi det dikterer et elements position på den periodiske tabel. Dette giver dig igen mulighed for at bruge de periodiske tendenser:
* på tværs af en periode (venstre til højre): Elektronegativitet øges generelt, hvilket betyder, at elementer bliver mere tilbøjelige til at få elektroner og er mere reaktive som ikke -metaller.
* ned en gruppe (top til bund): Elektronegativitet falder generelt, hvilket betyder, at elementer bliver mere tilbøjelige til at miste elektroner og er mere reaktive som metaller.
2. Valenselektroner: Det er vigtigt at forstå antallet af valenselektroner. Du kan forudsige dette baseret på gruppens nummer på elementet (med nogle undtagelser). For eksempel har elementer i gruppe 1 (alkalimetaller) 1 valenselektron og er meget reaktive, mens elementer i gruppe 18 (ædelgasser) har en fuld ydre skal og er generelt ureaktive.
3. Andre faktorer:
* Metallisk vs. ikke -metallisk karakter: Metaller har en tendens til at miste elektroner og er reaktive på forskellige måder end ikke -metaller, som har en tendens til at vinde elektroner.
* ioniseringsenergi: Jo lavere ioniseringsenergi, jo lettere er det at fjerne en elektron og jo mere reaktivt elementet.
* Elektronaffinitet: Jo højere elektronaffinitet er, desto mere sandsynligt er et element at få en elektron, og jo mere reaktiv er det.
eksempel
Lad os se på elementerne natrium (NA) og klor (CL):
* natrium (NA): Atomnummer 11. Har 1 valenselektron og er meget reaktiv (et metal), fordi det let mister dette elektron for at opnå en stabil konfiguration.
* klor (Cl): Atomnummer 17. Har 7 valenselektroner og er også meget reaktiv (en ikke -metal), fordi det let får et elektron for at afslutte sin ydre skal.
Konklusion:
Atomnummer er et udgangspunkt, men du skal overveje de periodiske tendenser, valenselektronkonfiguration og andre faktorer som ioniseringsenergi og elektronaffinitet for nøjagtigt at vurdere et elements reaktivitet.
Sidste artikelBestemmer elektronet reaktivitet af et atom?
Næste artikelHvordan indikerede atommasse elementreaktivitet?
 Varme artikler
Varme artikler
-
 MOF co-katalysator tillader selektivitet af forgrenede aldehyder på op til 90 %Mikroporer af MOFer med visse topologier øger tætheden af olefinerne, mens de delvist forhindrer adsorptionen af syntesegassen. Kredit:@PSI Bestræbelser på at udvikle heterogene katalysatorer,
MOF co-katalysator tillader selektivitet af forgrenede aldehyder på op til 90 %Mikroporer af MOFer med visse topologier øger tætheden af olefinerne, mens de delvist forhindrer adsorptionen af syntesegassen. Kredit:@PSI Bestræbelser på at udvikle heterogene katalysatorer, -
 Flåtprotein hjælper antibiotika med at bekæmpe MRSA super bugKredit:stock.adobe.com Et protein afledt af flåter øger effektiviteten af antibiotikabehandling af methicillin-resistente Staphylococcus aureus, eller MRSA, ifølge en undersøgelse ledet af Yale.
Flåtprotein hjælper antibiotika med at bekæmpe MRSA super bugKredit:stock.adobe.com Et protein afledt af flåter øger effektiviteten af antibiotikabehandling af methicillin-resistente Staphylococcus aureus, eller MRSA, ifølge en undersøgelse ledet af Yale. -
 Side-by-side afsætning af atomisk flade halvlederplader forbedrer solcellekonverteringseffektivitet…Solenergikonvertering ved hjælp af en lateral WSe2-MoS2 heterojunction. Kredit:© 2017 WILEY VCH Supertynde fotovoltaiske enheder understøtter solteknologien, og der søges derfor meget efter gevins
Side-by-side afsætning af atomisk flade halvlederplader forbedrer solcellekonverteringseffektivitet…Solenergikonvertering ved hjælp af en lateral WSe2-MoS2 heterojunction. Kredit:© 2017 WILEY VCH Supertynde fotovoltaiske enheder understøtter solteknologien, og der søges derfor meget efter gevins -
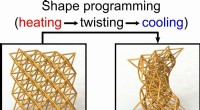 4-D-trykte materialer kan være stive som træ eller bløde som svamp4D-printede metamaterialer kan midlertidigt omdannes til enhver deformeret form og derefter returneres til deres oprindelige form efter behov, når de opvarmes. Skalaen er 2 millimeter. Kredit:Chen Yan
4-D-trykte materialer kan være stive som træ eller bløde som svamp4D-printede metamaterialer kan midlertidigt omdannes til enhver deformeret form og derefter returneres til deres oprindelige form efter behov, når de opvarmes. Skalaen er 2 millimeter. Kredit:Chen Yan
- Hvilken rækkefølge hører Hydra til?
- Sådan beregnes pH-effekten af Dilution
- Forskere producerer de første laser ultralydsbilleder af mennesker
- Ingeniører udvikler et HAL 9000-type AI-system til overvågning af planetbasestationer
- Canadas regulator skal genoverveje Trans Mountain-rørledningen til Stillehavet
- Hvorfor medarbejdere gør dårlige ting for virksomheder, de elsker


