Hvorfor de atomiske massetal, der er anført for elementer på periodisk tabel, er ikke hele tal.?
Her er hvorfor:
* isotoper: Atomer af det samme element kan have forskellige antal neutroner. Disse variationer kaldes isotoper. For eksempel har carbon to almindelige isotoper:carbon-12 (6 protoner, 6 neutroner) og carbon-14 (6 protoner, 8 neutroner).
* Mass af isotoper: Hver isotop har en lidt anden atommasse på grund af det forskellige antal neutroner.
* overflod: Isotoper af et element forekommer i naturen med varierende overflod.
* Vægtet gennemsnit: Den atommasse, der er anført på den periodiske tabel, beregnes ved at tage gennemsnittet af masserne af alle isotoper i dette element, vægtet af deres relative overflod.
Eksempel:
* Carbon-12 har en masse på 12 atommasseenheder (AMU) og er ca. 98,9% rigelig.
* Carbon-14 har en masse på 14 amu og er ca. 1,1% rigelig.
Den vægtede gennemsnitlige atommasse af kulstof beregnes som:
(0,989 * 12 amu) + (0,011 * 14 amu) ≈ 12,01 amu
Dette forklarer, hvorfor atommassen af kulstof ikke er et helt tal, men snarere 12,01 amu.
Kortfattet: Atommassenumrene på den periodiske tabel afspejler den gennemsnitlige masse af de forskellige isotoper af et element under hensyntagen til deres relative forekomst. Derfor er de ikke hele tal.
Sidste artikelEr det at bryde glasskemisk eller fysisk?
Næste artikelHvad er smeltede materialer?
 Varme artikler
Varme artikler
-
 Forskere udforsker racemaser og foreslår strategier til at finde lægemidler, der er målrettet mod…Det aktive sted for alanin racemase, et vigtigt antibakterielt mål. Kredit:University of Bath Forskere fra Storbritanniens University of Bath udforsker racemaser-en vigtig type enzym, der er knytt
Forskere udforsker racemaser og foreslår strategier til at finde lægemidler, der er målrettet mod…Det aktive sted for alanin racemase, et vigtigt antibakterielt mål. Kredit:University of Bath Forskere fra Storbritanniens University of Bath udforsker racemaser-en vigtig type enzym, der er knytt -
 At bryde grænsen for kemiske forbindelserKredit:CC0 Public Domain Siden slutningen af det 19. århundrede, overgangsmetalcarbonyler har været en vigtig og velkendt klasse af forbindelser inden for koordinationskemi og organometallisk ke
At bryde grænsen for kemiske forbindelserKredit:CC0 Public Domain Siden slutningen af det 19. århundrede, overgangsmetalcarbonyler har været en vigtig og velkendt klasse af forbindelser inden for koordinationskemi og organometallisk ke -
 Glimmer giver et fingerpeg om, hvordan vand transporterer mineralerForskere ved Argonne så på dynamikken i transporten af visse elementer - især rubidium - ved grænsefladen mellem vand og glimmer, et fladt gennemsigtigt mineral afbilledet ovenfor. Kredit:Beth Harve
Glimmer giver et fingerpeg om, hvordan vand transporterer mineralerForskere ved Argonne så på dynamikken i transporten af visse elementer - især rubidium - ved grænsefladen mellem vand og glimmer, et fladt gennemsigtigt mineral afbilledet ovenfor. Kredit:Beth Harve -
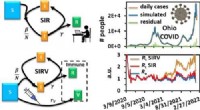 Kemi-laboratoriestuderende forudsiger spredning af COVID-19 med kinetikmodellerI denne graf forudsagde studerende i forårets kinetiklaboratorium daglige tilfælde i staten Ohio til efteråret 2022. Kredit:Ohio University Kemiker Jixin Chen så på den hurtige spredning af COVID-1
Kemi-laboratoriestuderende forudsiger spredning af COVID-19 med kinetikmodellerI denne graf forudsagde studerende i forårets kinetiklaboratorium daglige tilfælde i staten Ohio til efteråret 2022. Kredit:Ohio University Kemiker Jixin Chen så på den hurtige spredning af COVID-1
- Deliveroo på prøve i Madrid over arbejderstatus
- Ikke al porno er skabt lige - findes der sådan noget som sund pornografi?
- Opfyldelse af mål for bæredygtig udvikling kræver mere samarbejde mellem discipliner
- Definition af Net Ecosystem Exchange
- Hvornår kan vi sige, at objektet er i bevægelse?
- Røde flag love for at forhindre masseskyderier:Hvad viser forskningen?


