Hvilken kemisk binding opbevarer mest energi?
Her er en sammenbrud:
* obligationsstyrke: Henviser til den mængde energi, der kræves for at bryde en bestemt obligation.
* faktorer, der påvirker obligationsstyrken:
* type obligation:
* kovalente obligationer (deling af elektroner) er generelt stærkere end ioniske bindinger (overførsel af elektroner).
* Flere obligationer (dobbelt- eller tredobbelt obligationer) er stærkere end enkeltobligationer.
* atomer involveret: Mindre atomer med større elektronegativitetsforskelle har en tendens til at danne stærkere bindinger.
* obligationslængde: Kortere obligationer er typisk stærkere.
Eksempler på stærke obligationer:
* c =O (carbonylbinding): Fundet i ketoner, aldehyder og carboxylsyrer. Det er ret stærkt på grund af dobbeltbindingskarakter og elektronegativitetsforskellen mellem kulstof og ilt.
* c-h (carbon-hydrogenbinding): En relativt stærk enkelt binding, der bidrager til stabiliteten af mange organiske molekyler.
* n≡n (nitrogen tredobbelt binding): Den stærkeste enkeltbinding, der findes i nitrogengas, kræver en masse energi til at bryde.
Vigtig note: Begrebet "mest energi" er lidt vildledende. Det er mere nøjagtigt at sige, at nogle obligationer er stærkere og kræver mere energi for at bryde end andre. Den specifikke mængde energi, der er gemt i en binding, varierer baseret på de faktorer, der er nævnt ovenfor.
Hvis du er nysgerrig efter et specifikt molekyle eller reaktion, kan jeg give mere detaljerede oplysninger om de relevante obligationsstyrker.
Sidste artikelHvordan parres N-baser af DNA-molekyler?
Næste artikelHvad er polariserbare anioner?
 Varme artikler
Varme artikler
-
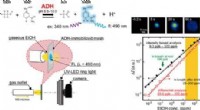 Sniff-cam for at opdage sygdomKredit:American Chemical Society At have dårlig ånde kan betyde, at nogen spiste en ildelugtende frokost, men det kan indikere, at personen er syg. Forskellige duftforbindelser er blevet forbundet
Sniff-cam for at opdage sygdomKredit:American Chemical Society At have dårlig ånde kan betyde, at nogen spiste en ildelugtende frokost, men det kan indikere, at personen er syg. Forskellige duftforbindelser er blevet forbundet -
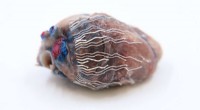 Tynd, strækbare biosensorer kan gøre operationen mere sikkerDe nye biosensorer giver mulighed for samtidig optagelse og billeddannelse af væv og organer under kirurgiske procedurer. På dette bilede, forskere fastgjorde biosensoren til hjertet af en gris, der b
Tynd, strækbare biosensorer kan gøre operationen mere sikkerDe nye biosensorer giver mulighed for samtidig optagelse og billeddannelse af væv og organer under kirurgiske procedurer. På dette bilede, forskere fastgjorde biosensoren til hjertet af en gris, der b -
 Forskere optrævler mysterierne om irreversibilitet i elektrokrome tynde filmSmarte vinduer, en af de mest lovende anvendelser af wolframoxid (WO3) tynde film, er transmissionskontrollerbare vinduer, der bruges i biler, fly, og bygningsapplikationer. Kredit:Joel Filipe fra S
Forskere optrævler mysterierne om irreversibilitet i elektrokrome tynde filmSmarte vinduer, en af de mest lovende anvendelser af wolframoxid (WO3) tynde film, er transmissionskontrollerbare vinduer, der bruges i biler, fly, og bygningsapplikationer. Kredit:Joel Filipe fra S -
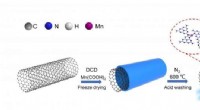 Mangan-enkeltatom-katalysator øger ydeevnen af elektrokemisk reduktion af kuldioxidSkematisk diagram af Mn SAC-fremstilling og mekanisme for elektrokemisk CO 2 reduktion. Kredit:FENG jiaqi Elektrokemisk CO 2 reduktionsreaktion (CO 2 RR) er en lovende tilgang til at omdanne
Mangan-enkeltatom-katalysator øger ydeevnen af elektrokemisk reduktion af kuldioxidSkematisk diagram af Mn SAC-fremstilling og mekanisme for elektrokemisk CO 2 reduktion. Kredit:FENG jiaqi Elektrokemisk CO 2 reduktionsreaktion (CO 2 RR) er en lovende tilgang til at omdanne
- Hvad reduceres lidt olie i videnskaben?
- Hvor mange valenselektron er der i svovl?
- Hvilke egenskaber bruges til at klassificere organismer i domæner og kongeriger?
- Hvad menes der med systemets indre energi?
- 3 spørgsmål:Ben Weiss diskuterer, hvad en våd måne kan betyde
- Hvorfor er biotransformation vigtig?


